题目内容
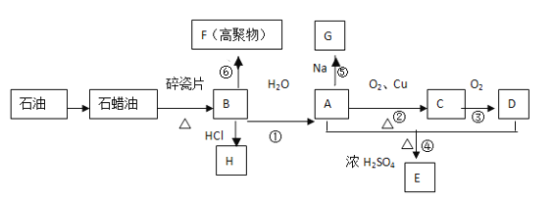
【题目】已知A是化学实验室中最常见的有机物,它易溶于水并有特殊香味;B的产量可以衡量一个国家石油化工发展的水平,有关物质的转化关系如图所示![]() 部分反应条件、产物省略
部分反应条件、产物省略![]() :
:
回答下列问题:
(1)工业上由石蜡油获得B的方法称为__________。
![]() 决定化合物A的化学特性的原子团的名称为______________。
决定化合物A的化学特性的原子团的名称为______________。
![]() 到A的反应类型为____________,A到E的反应类型为________________。
到A的反应类型为____________,A到E的反应类型为________________。
(3)写出下列反应的化学方程式。
反应②:________________________________________________________;
反应⑥:_________________________________________________________。
(4)工业上制备H有以下两种方案:Ⅰ![]() 乙烷与氯气反应; Ⅱ
乙烷与氯气反应; Ⅱ![]() 乙烯与氯化氢反应。你认为最合理的方案是________
乙烯与氯化氢反应。你认为最合理的方案是________![]() 填代号
填代号![]() ,理由是__________________________。
,理由是__________________________。
【答案】石油的裂解 羟基 加成反应 酯化反应 2CH3CH2OH+ O2 ![]() 2CH3CHO + 2H2O nCH2=CH2
2CH3CHO + 2H2O nCH2=CH2![]()
![]() Ⅱ 乙烷与氯气发生取代反应,能生成一氯乙烷、二氯乙烷、三氯乙烷等多种产物,产物含有杂质较多
Ⅱ 乙烷与氯气发生取代反应,能生成一氯乙烷、二氯乙烷、三氯乙烷等多种产物,产物含有杂质较多
【解析】
B的产量可以用来衡量一个国家的石油化工水平,则B为CH2=CH2,石油分馏得到石蜡油,石蜡油裂解得到乙烯,乙烯发生加聚反应生成F为![]() ;乙烯与水发生加成反应生成A为CH3CH2OH,乙醇在Cu或Ag作催化剂条件下发生氧化反应生成C为CH3CHO,CH3CHO可进一步氧化生成D为CH3COOH,CH3CH2OH和CH3COOH在浓硫酸作用下反应生成乙酸乙酯,故E为CH3COOCH2CH3,乙烯与HCl发生加成反应生成H为CH3CH2Cl,乙醇与Na反应生成G为CH3CH2ONa。
;乙烯与水发生加成反应生成A为CH3CH2OH,乙醇在Cu或Ag作催化剂条件下发生氧化反应生成C为CH3CHO,CH3CHO可进一步氧化生成D为CH3COOH,CH3CH2OH和CH3COOH在浓硫酸作用下反应生成乙酸乙酯,故E为CH3COOCH2CH3,乙烯与HCl发生加成反应生成H为CH3CH2Cl,乙醇与Na反应生成G为CH3CH2ONa。
(1)B是乙烯,石蜡油是高沸点烃,由石蜡油发生裂解反应可获得乙烯。
![]() A是CH3CH2OH,决定化合物CH3CH2OH的化学特性的原子团是-OH,名称为羟基。
A是CH3CH2OH,决定化合物CH3CH2OH的化学特性的原子团是-OH,名称为羟基。
②乙烯与水反应生成CH3CH2OH,反应类型为加成反应,CH3CH2OH与乙酸在浓硫酸作用下发生酯化反应生成CH3COOCH2CH3,反应类型为酯化反应。
(3)反应②是乙醇在Cu或Ag作催化剂条件下发生氧化反应生成CH3CHO,反应方程式是:2CH3CH2OH+ O2 ![]() 2CH3CHO + 2H2O;
2CH3CHO + 2H2O;
反应⑥是乙烯发生加聚反应生成F为![]() ,反应方程式是nCH2=CH2
,反应方程式是nCH2=CH2![]()
![]() 。
。
(4)Ⅰ、乙烷与氯气发生取代反应生成一氯乙烷、二氯乙烷、三氯乙烷等多种产物,产物含有杂质较多,Ⅱ、乙烯与氯化氢反应只生成一氯乙烷,所以最合理的方案是Ⅱ。

 新题型全程检测期末冲刺100分系列答案
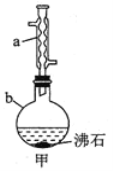
新题型全程检测期末冲刺100分系列答案【题目】乙酸乙酯是制药工业和有机合成中的重要原料,实验室制备乙酸乙酯的实验装置![]() 夹持及加热装置已略去
夹持及加热装置已略去![]() 、有关数据和实验步骤如下所示。
、有关数据和实验步骤如下所示。
物质 | 相对分子质量 | 密度 | 沸点 | 在水中的溶解性 |
乙醇 | 46 |
| 80 | 以任意比互溶 |
乙酸 | 60 |
| 118 | 易溶 |
乙酸乙酯 | 88 |
| 77 | 难溶 |
实验步骤:
![]() 向仪器b中加入9.5 mL乙醇(过量)和6 mL乙酸,再缓慢加入2.5 mL浓硫酸,混合均匀后,加入沸石,然后装上冷凝管
向仪器b中加入9.5 mL乙醇(过量)和6 mL乙酸,再缓慢加入2.5 mL浓硫酸,混合均匀后,加入沸石,然后装上冷凝管![]() 如图甲所示
如图甲所示![]() 。
。
![]() 小火加热仪器b,缓慢回流0.5 h,待瓶内反应物冷却后,将回流装置改成蒸馏装置,加热蒸出乙酸乙酯。
小火加热仪器b,缓慢回流0.5 h,待瓶内反应物冷却后,将回流装置改成蒸馏装置,加热蒸出乙酸乙酯。
![]() 向馏出液中缓慢加入5mL饱和碳酸钠溶液,振荡,直至不再有二氧化碳气体产生,然后将混合液转移至分液漏斗中,分去水层,将有机层依次用5mL饱和食盐水和5mL饱和氯化钙溶液洗涤后,转移至锥形瓶中,加入少量无水
向馏出液中缓慢加入5mL饱和碳酸钠溶液,振荡,直至不再有二氧化碳气体产生,然后将混合液转移至分液漏斗中,分去水层,将有机层依次用5mL饱和食盐水和5mL饱和氯化钙溶液洗涤后,转移至锥形瓶中,加入少量无水![]() 固体,静置片刻,过滤除去
固体,静置片刻,过滤除去![]() 固体,然后将有机层进行蒸馏纯化,收集
固体,然后将有机层进行蒸馏纯化,收集![]() 时的馏分,得到
时的馏分,得到![]() 乙酸乙酯。
乙酸乙酯。
请回答下列问题:
(1)实验原理:乙酸与乙醇在催化剂存在的条件下加热可以发生酯化反应生成乙酸乙酯,请用氧同位素示踪法写出CH3CO18OH与CH3CH2OH发生酯化反应的化学方程式。______________。
(2)仪器a的名称为______________,仪器b的规格为_______![]() 填字母
填字母![]() 。
。
A.25 mL B.50mL C.250 mL D.500mL ![]()
(3)步骤![]() 中,将馏出液经饱和碳酸钠溶液处理后的混合液置于分液漏斗中,振荡后静置,水层在________
中,将馏出液经饱和碳酸钠溶液处理后的混合液置于分液漏斗中,振荡后静置,水层在________![]() 填“上层”或“下层”
填“上层”或“下层”![]() 。
。
(4)在步骤![]() 中,加入少量无水硫酸镁固体的作用是__________________________。
中,加入少量无水硫酸镁固体的作用是__________________________。
(5)酯层厚度的标定:加热回流一段时间后再蒸出产物,为了更好地测定有机层厚度,可预先向饱和碳酸钠溶液中加入1滴_________试液,现象是 ___________________。
(6)该实验中乙酸乙酯的产率为_______ (计算结果精确到![]() )。
)。