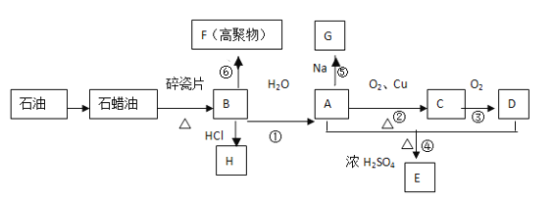
题目内容
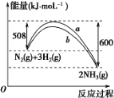
【题目】一定条件下,A与B反应可生成C和D,其能量变化如图:

(1)下列有关反应A+B=C+D的说法正确的是________。
A.反应前后原子的种类和数目一定不变
B.该反应若有热量变化,则一定是氧化还原反应
C.若该反应为放热反应,则不需要加热反应就一定能自发进行
D.反应物的总质量、总能量与反应产物的总质量、总能量均相等
(2)若E1<E2,则反应产物的总能量________(填“>”“<”或“=”)反应物的总能量,反应热Q________0(填“>”“<”或“=”)。
【答案】A>>
【解析】
(1)A、化学反应遵循质量守恒定律,则化学反应前后原子重新组合,反应前后原子的种类和数目一定不变,A正确;
B、依据反应的实质是旧键断裂,新键形成分析,化学反应过程中一定存在能量的变化,但不一定是氧化还原反应,B错误;
C、大多放热反应需要加热引发,反应条件与反应是放热反应或吸热无关,C错误;
D、依据化学反应质量守恒可知,参加反应的反应物的总质量与生成物的总质量一定相等,化学反应过程中一定存在能量的变化,因此反应物和生成物的总能量一定不相等,D错误;
答案选A。
(2)若E1<E2,则生成物的总能量大于反应物的总能量,依据反应前后能量守恒可知反应是吸热反应,因此反应热Q>0。

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目