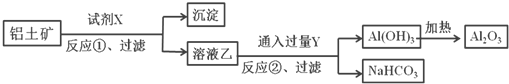
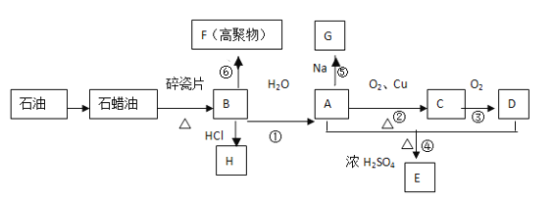
题目内容
【题目】现有短周期主族元素X、Y、Z、R、T,R原子的最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Y与T同主族。五种元素原子半径与原子序数之间的关系如图所示。下列推断正确的是( )
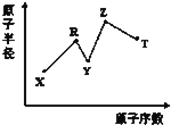
A. 离子半径:Y<Z
B. 氢化物的沸点:Y<T
C. 最高价氧化物对应水化物的酸性:T<R
D. 由X、Y、Z、R四种元素组成的常见化合物中含有离子键
【答案】D
【解析】
Y与Z能形成Z2Y、Z2Y2型离子化合物,Z是Na元素、Y是O元素;Y与T同主族,Y的原子序数小于T,所以T是S元素。R的原子序数小于O,R原子的最外层电子数是电子层数的2倍,R是C元素;X的半径、原子序数都小于C原子,所以X是H元素。
A. 电子层数相同,质子数越多半径越小,离子半径:Na+<O2-,故A错误;
B. 水分子间形成氢键,氢化物的沸点:H2S<H2O,故B错误;
C. S的非金属性大于C,最高价氧化物对应水化物的酸性:H2CO3<H2SO4,故C错误;
D. 由H、O、Na、C四种元素组成的常见化合物NaHCO3中含有离子键,故D正确,答案选D。

练习册系列答案
相关题目