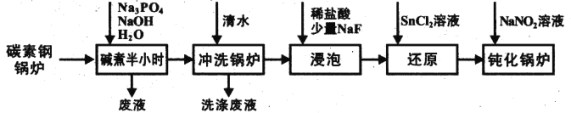
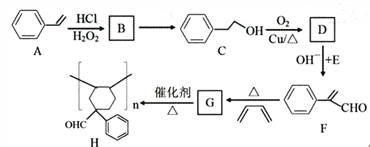
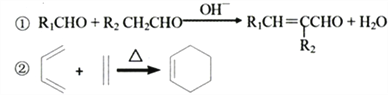
题目内容
【题目】第四周期过渡元素如铁、锰、铜、锌等在太阳能电池、磁性材料等科技方面有广泛的应用,回答下列问题:
(1)Fe的基态原子共有____种不同能级的电子。
(2)已知高温下CuO→Cu2O+O2,从铜原子价层电子结构(3d和4s轨道上应填充的电子数)变化角度来看,能生成Cu2O的原因是___。比较铁与锰的第三电离能(I3):铁__锰(填“>”、 “=”或“<”),原因是___。
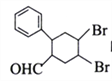
(3)某含铜化合物的离子结构如图所示。
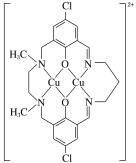
①该离子中存在的作用力有______________;
a.离子键 b.共价键 c.配位键 d.氢键 e.范德华力
②该离子中N原子的杂化类型有____________。
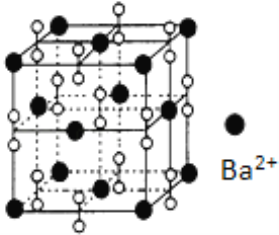
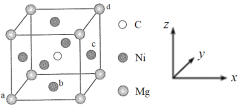
(4)如图是晶体Fe3O4的晶胞,该晶体是一种磁性材料,能导电。
①晶胞中二价铁离子处于氧离子围成的______(填空间结构)空隙。
②晶胞中氧离子的堆积方式与某金属晶体原子堆积方式相同,该堆积方式名称为________。
③解释Fe3O4晶体能导电的原因__________;若晶胞的体对角线长为anm,则 Fe3O4 晶体的密度为______g·cm-3(阿伏加德罗常数用NA表示)。
【答案】7 CuO中铜的价层电子排布为3d94s0,Cu2O中铜的价层电子排布为3d10,后者处于稳定的全充满状态而前者不是 小于 Mn2+、Fe2+的价电子排布式分别为3d5、3d6,Mn2+处于3d5半满较稳定结构,再失去一个电子所需能量较高,所以第三电离能Fe小于Mn bc sp2、sp3 正四面体 面心立方堆积 电子可在两种不同价态的铁离子间快速发生转移 ![]()
【解析】
(1)依据铁原子的和外电子排布式,找出不同的能级;
(2)从+2价的铜到+1价的铜,核外电子排布的稳定性考虑即可;Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,故铁的第三电离能I3(Fe)比锰的第三电高能I3(Mn)小;
(3)①根据结构图及化学键的类型作答;
②根据杂化轨道理论分析;
(4)①观察图示,图中虚线提示Fe2+连接四个氧离子,分析结构;
②体心立方堆积是八个顶点加一个体心,面心立方最密堆积是八个顶点加六个面心,细心观察,可以在左边补一个晶胞去观察;
③晶胞中有Fe2+和Fe3+,Fe2+失电子转化为Fe3+,Fe3+得电子转化为Fe2+;根据均摊法去计算晶胞密度。
(1)Fe原子核外有26个电子,基态Fe原子的核外电子排布式为:1s22s22p63s23p63d64s2,则Fe的基态原子共有1s、2s、2p、3s、3p、3d和4s共7种不同能级的电子,
故答案为:7;
(2)Cu2+的价电子结构为3d9,Cu+的价电子结构为3d10,3d10为稳定结构,所以在高温时,Cu2+得一个电子变成稳定结构的Cu+;Mn2+、Fe2+的价电子排布式分别为3d5、3d6,Mn2+处于3d5半满较稳定结构,再失去一个电子所需能量较高,所以第三电离能Fe小于Mn,
故答案为:CuO中铜的价层电子排布为3d94s0,Cu2O中铜的价层电子排布为3d10,后者处于稳定的全充满状态而前者不是;小于;Mn2+、Fe2+的价电子排布式分别为3d5、3d6,Mn2+处于3d5半满较稳定结构,再失去一个电子所需能量较高,所以第三电离能Fe小于Mn;
(3)①根据结构图可以判断,该离子中含有共价键和配位键,答案选bc,
故答案为:bc;
②N由单键连接的,为sp3杂化,双键连接的为sp2杂化,
故答案为:sp2、sp3;
(4)①观察图示可知,Fe2+连接四个氧离子,四个氧离子为正四面体顶点,Fe2+在正四面体中心;
故答案为:正四面体;
②往图中晶胞左边加一个晶胞会发现氧离子是八个顶点加六个面心,所以堆积方式为面心立方最密堆积;
故答案为:面心立方最密堆积;
③电子的得失转移能使晶胞导电,因此四氧化三铁晶体能导电的原因是电子可在两种不同价态的铁离子间快速发生转移;
根据晶胞的均摊计算,晶胞中含有的铁离子的个数为4×![]() +3×
+3×![]() = 2,亚铁离子的个数为1,氧离子的个数为1+12×
= 2,亚铁离子的个数为1,氧离子的个数为1+12×![]() = 4,若晶胞体对角线长为a nm,设边长为x nm,面对角线为
= 4,若晶胞体对角线长为a nm,设边长为x nm,面对角线为![]() ,则体对角线长为
,则体对角线长为![]() ,故
,故![]() ,晶胞的体积为
,晶胞的体积为![]() ,晶胞的质量为
,晶胞的质量为![]() ,故密度
,故密度![]() ,
,
故答案为:![]() 。
。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
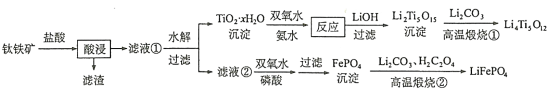
回答下列问题:
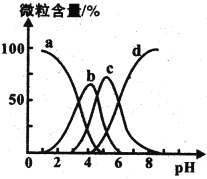
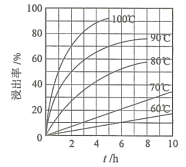
(1)“酸浸”实验中,铁的浸出率结果如图所示。由图可知,当铁的浸出率为70%时,所采用的实验条件为___________________。“酸浸”实验中为了提高酸浸的效率,除了升温还可以采取的措施有___________________(至少写两种)。
(2)“酸浸”后,“滤液①”钛主要以![]() 形式存在,写出其水解生成TiO2·xH2O的离子方程式__________________。
形式存在,写出其水解生成TiO2·xH2O的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40 ℃时TiO2·xH2O转化率最高的原因__________________。
(4)若“滤液②”中![]() ,加入双氧水和磷酸(设溶液体积增加1倍),使
,加入双氧水和磷酸(设溶液体积增加1倍),使![]() 恰好沉淀完全即溶液中
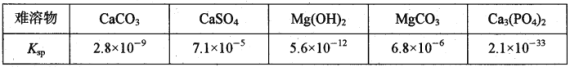
恰好沉淀完全即溶液中![]() ,此时是否有Mg3(PO4)2沉淀生成?_____________(列式计算)。FePO4、Mg3(PO4)2的Ksp分别为
,此时是否有Mg3(PO4)2沉淀生成?_____________(列式计算)。FePO4、Mg3(PO4)2的Ksp分别为![]() 。
。