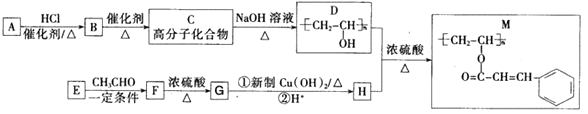
题目内容
【题目】工业锅炉内壁的水垢,不仅浪费燃料,而且容易引发安全隐患。某碳素钢锅炉水垢(主要成分有CaCO3、CaSO4、Mg(OH)2、Fe2O3、SiO2等)碱煮法清除的流程如下:

已知:20℃时几种难溶物的溶度积常数如下表(单位省略):

回答下列问题:
(1)“碱煮”环节,加入Na3PO4的主要目的是将CaSO4转化为Ca3(PO4)2,请写出该离子方程式______________________。
(2)“浸泡过程中,稀盐酸会溶解Fe2O3。溶解后的Fe2O3会加速锅炉腐蚀,故需“还原”处理。
①锅炉被加速腐蚀的原因是______________________;
②浸泡液还原”处理时,Sn2+转化为Sn4+,则反应中氧化剂与还原剂的物质的量之比为______________________。
(3)“钝化”处理的目的是在锅炉表面形成Fe3O4保护膜,同时生成可直接参与大气循环的气体。
①反应的离子方程式为_________________________________;
②为检验锅炉“钝化”处理后是否形成致密的保护膜,可往锅炉内壁刷上硫酸铜溶液。若观察到______________________(填现象),则保护膜致密性欠佳。
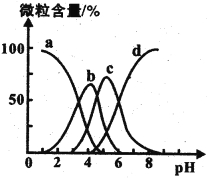
(4)柠檬酸(用H3R表示)可用作清除锅炉水垢的酸洗剂,溶液中H3R、H2R-、HR2-、R3-的含量与pH的关系如图所示。由此可推知,0.1 mol ·L-1 Na2HR溶液中各种阴离子浓度由大到小的排列顺序为______________________。
(5)用如图装置对锅炉用水(含Ca2+、Mg2+、HCO3-)进行预处理,可有效防止水垢形成。电解时,Ca2+形成沉淀的电极反应式为______________________。

【答案】3CaSO4+2PO43-=Ca3(PO4)2+3SO42- Fe+2Fe3+=3Fe2+ 2:1 9Fe+8NO2-+4H2O=4N2↑+3Fe3O4+8OH- 表面有红色物质出现 C(HR2-)>C(R2-)>C(OH-)>C(H2R-) 2Ca2++2HCO3-+2e-=2CaCO3↓+H2↑(或2H2O++2e-=2OH-+H2↑, 2Ca2++ OH-+HCO3-=CaCO3↓+H2O)
【解析】
(1) Na3PO4 的作用是使坚硬、致密的硫酸钙生成磷酸钙,3CaSO4+2Na3PO4=Ca3(PO4)2+3Na2SO4,改写成离子方程式;
(2)①Fe3+具有氧化性可以与具有还原性的铁反应生成亚铁离子,会腐蚀锅炉;
②发生了2Fe3++Sn2+=2Fe2++Sn4+反应,根据方程式得结果;
(3) ①反应物亚硝酸钠和铁,产物是四氧化三铁和氮气,写出离子方程式;
②如果没有形成致密的保护膜,往锅炉内壁刷上硫酸铜溶液则会发生反应Fe+CuSO4=FeSO4+Cu;
(4)根据图像分析可知HR2-浓度最大时PH<7,可得结论Na2HR溶液中HR2-的电离平衡大于水解平衡。由此推知0.1 mol ·L-1 Na2HR溶液中各种阴离子浓度由大到小的排列顺序;
(5)依据电解水原理分析即可。
(1) Na3PO4的作用是使坚硬、致密的硫酸钙生成磷酸钙3CaSO4+2Na3PO4=Ca3(PO4)2+3Na2SO4,改写成离子方程式;
正确答案:3CaSO4+2PO43-=Ca3(PO4)2+3SO42-
(2)①Fe3+具有氧化性可以与具有还原性的铁反应生成亚铁离子,会腐蚀锅炉;
正确答案:Fe+2Fe3+=3Fe2+。
②发生了2Fe3++Sn2+=2Fe2++Sn4+反应,根据方程式得结果;
正确答案:2:1。
(3) ①反应物亚硝酸钠和铁,产物是四氧化三铁和氮气,写出离子方程式;
正确答案:9Fe+8NO2-+4H2O=4N2↑+3Fe3O4+8OH-
②如果没有形成致密的保护膜,往锅炉内壁刷上硫酸铜溶液则会发生反应Fe+CuSO4=FeSO4+Cu;
正确答案:表面有红色物质出现。
(4) 根据图像分析可知HR2-浓度最大时pH<7,可得结论Na2HR溶液中HR2-的电离程度大于水解程度。盐类的水解程度和弱电解解的电离程度通常较小,溶液中的氢氧根离子来自于水的电离及盐的水解,由此推知0.1 mol ·L-1 Na2HR溶液中各种阴离子浓度由大到小的排列顺序;
正确答案:c(HR2-)>c(R2-)>c(OH-)>c(H2R-)
(5) 依据电解水原理分析,电解锅炉水实际上就是电解水,水电离出的氢离子在阴极放电,故阴极附近氢氧根浓度偏大,与锅炉水中的钙镁离子生成沉淀,与电源负极相连的极是阴极,即b极附近生成沉淀;
正确答案:2Ca2++2HCO3-+2e-=2CaCO3↓+H2↑(或2H2O++2e-=2OH-+H2↑, 2Ca2++OH-+HCO3-=CaCO3↓+H2O)

 阅读快车系列答案
阅读快车系列答案【题目】实验室可利用环己醇的氧化反应制备环己酮,反应原理和实验装置(部分夹持装置略去)如下:

有关物质的物理性质见下表。
物质 | 沸点(℃) | 密度(g/cm3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.96 | 能溶于水和醚 |
环己酮 | 155.6(95.0)* | 0.95 | 微溶于水,能溶于醚 |
水 | 100.0 | 1.0 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。
实验中通过装置B将酸性Na2Cr2O7溶液加到盛有10mL环己醇的A中,在55~65℃进行反应。反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物。
(1)仪器D的名称为_____。
(2)①滴加酸性Na2Cr2O7溶液时反应的离子方程式为______________;
②蒸馏不能分离环己酮和水的原因是_____。
(3)环己酮需要经过以下操作提纯:
a.往液体中加入NaCl固体至饱和,静置,分液
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.加入无水MgSO4固体,除去有机物中少量的水
d.过滤
e.蒸馏、除去乙醚后,收集151~156℃馏分
①b中水层用乙醚萃取的目的是_____;
②上述操作a、d中使用的玻璃仪器除烧杯、玻璃棒外,还需要的玻璃仪器有____、___,操作a中,加入NaCl固体的作用是_____。
(4)恢复至室温时,分离得到纯产品体积为8mL,则环己酮的产率为____。(保留3位有效数字)