题目内容
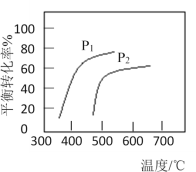
【题目】已知:断裂1 mol C=C键、1 mol C-H键、1 mol H-H键、1 mol C-C键吸收的能量分别为615 kJ、413.5 kJ、436 kJ、347 kJ;键能是指气态基态原子形成1 mol化学键释放的最低能量,单位为kJ·mol-1,乙烯转化为乙烷的过程如图所示,下列说法正确的是

A.C=C键的键能小于C-C键的键能
B.由乙生成1 mol丙时放出的能量为2001 kJ
C.CH2=CH2(g)、H2(g)反应生成1 mol CH3CH3(g)时放出的能量为123 kJ
D.甲、乙、丙中物质含有的总能量大小关系为乙>丙>甲
【答案】C
【解析】
A. C=C键键能为615 kJ/mol,C-C键键能为347 kJ/mol,所以C=C键的键能大于C-C键的键能,A错误;
B.形成化学键释放能量,则由乙生成1 mol丙时放出的能量为(347+413.5×6) kJ=2828 kJ,B错误;
C. 焓变等于断裂化学键吸收的能量减去成键释放的能量,则CH2=CH2+H2→CH3CH3反应的△H=(615+413.5×4+436-347-413.4×6)kJ/mol=-123 kJ/mol,C正确;
D.断键吸收变为单个气态原子吸收热量,使物质的内能增加,则物质能量:乙>甲;形成化学键释放能量,物质的内能减小,则物质含有的能量乙>丙;根据选项C可知物质甲变为丙放出热量,说明甲的能量比丙高,故甲、乙、丙中物质含有的总能量大小关系为乙>甲>丙,D错误;
故合理选项是C。

【题目】下图是物质间发生化学反应的颜色变化,下表选项物质对应正确的是
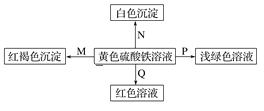
选项 | M | N | P | Q |
A | NH3·H2O | Ba(OH)2 | 铜 | KSCN |
B | Na | BaCl2 | FeO | KSCN |
C | NaOH | Ba(NO3)2 | 铁粉 | KSCN |
D | Na2O2 | MgCl2 | 锌粉 | KSCN |
A.AB.BC.CD.D