题目内容
【题目】某同学用标准![]() 溶液来测定未知浓度的盐酸的浓度:
溶液来测定未知浓度的盐酸的浓度:
(1)配制250mL 0.5mol/L的![]() 溶液所需的玻璃仪器为________________________。
溶液所需的玻璃仪器为________________________。
(2)用滴定管准确量取20.00mL未知浓度的盐酸于锥形瓶中,加入酚酞作指示剂,用![]() 溶液滴定到终点。
溶液滴定到终点。
该同学进行了三次实验,实验数据如下表:
实验编号 | 盐酸的体积(mL) | 标准 |
1 | 20.00 | 18.20 |
2 | 17.10 | |
3 | 16.90 |
滴定中误差较大的是第______次实验,造成这种误差的可能原因是______(填选项编号)
a、在盛装未知浓度的盐酸之前锥形瓶里面有少量蒸馏水,未烘干
b、滴定管在盛装标准![]() 溶液前未润洗
溶液前未润洗
c、滴定开始前盛装标准![]() 溶液的滴定管尖嘴部分有气泡,滴定终点读数时未发现气泡
溶液的滴定管尖嘴部分有气泡,滴定终点读数时未发现气泡
d、滴定开始前盛装标准![]() 溶液的滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
溶液的滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
e、滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
f、达到滴定终点时,俯视溶液凹液面最低点读数
g、滴定到终点时,溶液颜色由无色变到了红色
(3)该同学所测得盐酸的物质的量浓度为______________________(结果保留三位小数)。
【答案】烧杯、玻璃棒、250mL容量瓶、胶头滴管 1 bcg 0.425mol/L
【解析】
据配制溶液的实验过程判断所需玻璃仪器;用“滴多偏高、滴少偏低”分析实验误差;由中和滴定原理计算待测溶液的浓度。
(1)通常用NaOH固体配制250mL 0.5mol/L的溶液。步骤为计算、称量(托盘天平、药匙、烧杯)、溶解(玻璃棒)、转移(250mL容量瓶)、洗涤、定容(胶头滴管)、倒转摇匀。所需的玻璃仪器有烧杯、玻璃棒、250mL容量瓶、胶头滴管。
(2)平行实验中,滴定20.00mL未知浓度的盐酸所耗NaOH溶液体积应当相近。表中第1次所用NaOH溶液18.20mL明显大于第2、3次实验结果,应当舍弃。
a、在盛装未知浓度的盐酸之前锥形瓶里面有少量蒸馏水,不影响消耗NaOH溶液体积;
b、盛装标准NaOH溶液的滴定管未润洗,标准NaOH溶液被滴定管内壁的水稀释,中和一定量盐酸所耗NaOH溶液体积偏大;
c、在滴定前后,滴定管尖嘴部分都应无气泡。滴定前盛装标准NaOH溶液的滴定管尖嘴部分有气泡,使初读数偏小,标准NaOH溶液的体积偏大;
d、在滴定终点读数时盛装标准NaOH溶液的滴定管尖嘴部分发现尖嘴部分有气泡,使终读数偏小,标准NaOH溶液的体积偏小;
e、滴定过程中锥形瓶中待测盐酸过量,有液滴飞溅出来即损失盐酸,使标准NaOH溶液的体积偏小;
f、滴定终点时,俯视溶液凹液面最低点读数,使终读数偏小,标准NaOH溶液的体积偏小;
g、本实验用酚酞做指示剂,滴定终点时溶液应由无色变成浅红色、且半分钟不变色。若溶液由无色变成红色,则NaOH过量,标准NaOH溶液的体积偏大。
综上,使标准NaOH溶液体积偏大的因素有bcg。
(3)第2、3次实验结果相近,取其平均值17.00mL计算盐酸浓度。由于NaOH~HCl,
有0.5mol/L×17.00mL=c(HCl)×20.00mL,解得c(HCl)=0.425mol/L。

 导学教程高中新课标系列答案
导学教程高中新课标系列答案【题目】乙酰水杨酸(阿司匹林)是目前常用药物之一。实验室通过水杨酸进行乙酰化制备阿司匹林的一种方法如下:
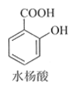 +(CH3CO)2O(醋酸酐)
+(CH3CO)2O(醋酸酐)![]()
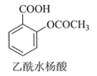 +CH3COOH
+CH3COOH
水杨酸 | 醋酸酐 | 乙酰水杨酸 | |
熔点/℃ | 157~159 | 72~ 74 | 135~138 |
相对密度/(g · cm3) | 1.44 | 1.10 | 1.35 |
相对分子质量 | 138 | 102 | 180 |
实验过程:在100 mL锥形瓶中加入水杨酸6.9 g及醋酸酐10 mL,充分摇动使固体完全溶解。缓慢滴加0.5 mL浓硫酸后加热,维持瓶内温度在70 ℃左右, 充分反应。稍冷后进行如下操作:
①在不断搅拌下将反应后的混合物倒入100 mL冷水中,析出固体,过滤。
②所得结晶粗品加入50 mL饱和碳酸氢钠溶液,溶解、过滤。
③滤液用浓盐酸酸化后冷却、过滤得固体。
④固体经纯化得白色的乙酰水杨酸晶体5.4 g。回答下列问题:
(1)该合成反应中应采用_____加热。(填标号)
A 热水浴 B 酒精灯 C 煤气灯 D 电炉
(2)下列玻璃仪器中,①中需使用的有_____(填标号)。
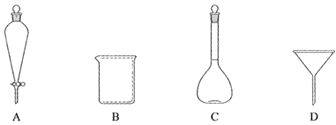
(3)①中需使用冷水,目的是_____。
(4)②中饱和碳酸氢钠的作用是_____,以便过滤除去难溶杂质。
(5)④采用的纯化方法为_____。
(6)本实验的产率是_____%。