题目内容
【题目】某化学兴趣小组用铁矿石(主要成分为Fe2O3,还有SiO2、A12O3等杂质)提取Fe2O3。操作讨程如下:

(1)(I)和(Ⅱ)步骤中分离溶液和沉淀的操作名称是_____________;
(2)沉淀A中主要含有_________________,固体B是________________;
(3)滤液Y中的阴离子除OH-、Cl-外,还有______________;
(4)写出(Ⅱ)步骤中生成Fe(OH)3的离子方程式________________________________。
【答案】过滤 SiO2或二氧化硅 Fe2O3或氧化铁 [Al(OH)4]-或A1O2- Fe3++3OH-=Fe(OH)3↓
【解析】
依据提取流程图可知,加入过量盐酸,氧化铁和氧化铝全部溶解为氯化铁和氯化铝溶液,二氧化硅不溶于盐酸为沉淀A;滤液中加入过量氢氧化钠溶液,氯化铁全部反应生成氢氧化铁沉淀,氯化铝全部反应生成偏铝酸钠溶液和氯化钠溶液,氢氧化铁加热分解生成氧化铁和水。
(1)(I)和(Ⅱ)步骤中分离溶液和沉淀的操作名称为过滤;
(2)二氧化硅和盐酸不反应,氧化铁、氧化铝和反应,所以沉淀A中主要含有SiO2,氢氧化铁受热分解生成氧化铁,则B是氧化铁;
(3)X中含有氯化铁、氯化铝和过量的盐酸,由于氢氧化铝能溶于氢氧化钠溶液中,所以滤液Y中还含有偏铝酸钠,故答案为:[Al(OH)4]-或A1O2-;
(4)氯化铁和氢氧化钠反应生成氢氧化铁和氯化钠,反应的离子方程式是Fe3++3OH-=Fe(OH)3↓。

 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案【题目】下表为元素周期表的一部分,a、b、c……为部分元素。回答下列问题:
a | |||||||||||||||||
f | h | i | |||||||||||||||
b | e | j | |||||||||||||||
c | d | g | k | ||||||||||||||
l | |||||||||||||||||
(1)请写出d元素的原子结构示意简图:___________________________________;
(2)请写出i的单质与a、h形成的化合物发生反应的化学方程式_______________________;
(3)请写出上述元素组成的物质间发生的与“(2)”反应类型相同且有固体非金属单质生成的化学反应方程式________________________________________________;
(4)g、e两种元素的最高价氧化物对应的水合物的化学性质相似,请写出g元素最高价氧化物对应的水合物与a、c、h三种元素形成的化合物反应的离子方程式:______________________________________________________;
(5)j、k、l三种元素之间能以原子个数比1∶1两两形成互化物,这些互化物的性质类似于这些元素单质的性质。请写出j、k的互化物与c、l形成的化合物等物质的量反应时的化学方程式________________。
(6)用电子式表示c、h两种元素以原子个数比1:1形成化合物的形成过程:______________________________________________________。
【题目】氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:(图中涉及物质为气态)

(1)如图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式______。
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表,
2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表,
t/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
请完成下列问题:
①试比较K1、K2的大小,K1______K2(填写“>”、“=”或“<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是_______(填序号字母)。
a .容器内N2,H2,NH3的浓度之比为1:3:2 b. υ(N2)正=3υ(H2)逆
c .容器内压强保持不变 d. 混合气体的密度保持不变
③在400℃时,当测得NH3和N2,H2的物质的量分别为1mol和2mol,3mol时,则该反应的υ(N2)正______υ(N2)逆(填写“>,“=”或“<”)。
【题目】由![]() 羟基丁酸生成
羟基丁酸生成![]() 丁内酯的反应如下:HOCH2CH2CH2COOH
丁内酯的反应如下:HOCH2CH2CH2COOH![]() +H2O
+H2O
在298K下,![]() 羟基丁酸水溶液的初始浓度为
羟基丁酸水溶液的初始浓度为![]() ,测得
,测得![]() 丁内酯的浓度随时间变化的数据如表所示。回答下列问题:
丁内酯的浓度随时间变化的数据如表所示。回答下列问题:
| 21 | 50 | 80 | 100 | 120 | 160 | 220 |
|
| 0.024 | 0.050 | 0.071 | 0.081 | 0.090 | 0.104 | 0.116 | 0.132 |
(1)该反应在50~80min内的平均反应速率为_____![]() 。
。
(2)120min时![]() 羟基丁酸的转化率为______。
羟基丁酸的转化率为______。
(3)298K时该反应的平衡常数![]() _____。
_____。
(4)为提高![]() 羟基丁酸的平衡转化率,除适当控制反应温度外,还可采取的措施是______。
羟基丁酸的平衡转化率,除适当控制反应温度外,还可采取的措施是______。
【题目】我国是世界上最早制得和使用金属锌的国家,一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:
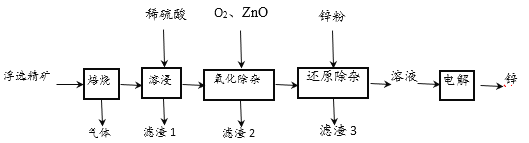
相关金属离子[c (Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 |
沉淀完全的pH | x | 8.3 | 8.2 | 9.4 |
常温下,Ksp[Fe(OH)3]=1×10-38,溶液中当离子浓度小于1×10-5mol/L时可认为沉淀完全。回答下列问题:
(1)用稀硫酸溶浸时,产生PbSO4和SiO2沉淀,经过滤后,向滤液中加入O2、ZnO,目的是除去杂质Fe2+、Fe3+,则氧化除杂工序中ZnO的作用是调节溶液的pH,应调节溶液的pH的范围为_______(填数值)。
(2)用铂电极电解硫酸锌溶液制备单质锌时,电解的总反应为________,电解使锌沉积后,电解液可返回_______工序循环使用。
【题目】下表是不同温度下水的离子积常数:
温度/℃ | 25 |
|
|
水的离子积常数 |
| a |
|
试回答以下问题:
(1)若![]() ,则α________(填“<”、“>”或“=”)
,则α________(填“<”、“>”或“=”)![]() ,作出此判断的理由是________________。
,作出此判断的理由是________________。
(2)![]() 下,某
下,某![]() 溶液中
溶液中![]() ,取该溶液
,取该溶液![]() ,加水稀释至
,加水稀释至![]() ,则稀释后溶液中
,则稀释后溶液中![]() ________。
________。
(3)![]() 下,将
下,将![]() 的苛性钠溶液
的苛性钠溶液![]() 与
与![]() 的稀硫酸
的稀硫酸![]() 混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的
混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的![]() ,则
,则![]() ________。此溶液中各种离子的浓度由大到小的排列顺序是___________。
________。此溶液中各种离子的浓度由大到小的排列顺序是___________。



