题目内容
【题目】已知:A(g)+ 2B(g)![]() C(g)+2D(s),经测定,在不同温度下该反应的平衡常数如下:
C(g)+2D(s),经测定,在不同温度下该反应的平衡常数如下:
温度(℃) | 250 | 300 | 350 |
K | 30 | 15.78 | 12.5 |
(1)该反应为__________反应(填“吸热”“放热”).平衡常数K的表达式为K=____________
(2)假设该反应在恒容绝热的密闭容器中进行,下列能判断该反应已达化学平衡状态的是________ ;
①容器中压强不变 ②混合气体中c(A)不变 ③2v正(B)=v逆(A) ④ 容器内温度不变 ⑤容器中混合气体的密度不变 ⑥ 平均摩尔质量不变 ⑦c(A):c(b):c(c)=1:2:1
A.除③以外 B.④⑤⑦ C.①②④⑤⑥ D.④⑤⑥⑦
(3)欲提高B的转化率并加快化学反应速率,下列措施可行的是_____________。(填字母)
a.在恒压下中再充入He b.向恒容体积再充入A
c.改变反应的催化剂 d.升高温度
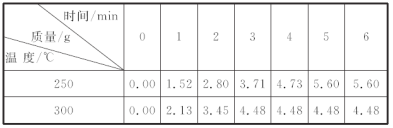
(4)若某温度下,该反应达到平衡时测得反应物与生成物的浓度为c(A)=0.4 mol·L-1、c(B)=0.4 mol·L-1、c(C)=0.8 mol·L-1, 则此时的温度为___________;
(5)某温度下,在体积固定的1L的密闭容器中将2 mol A和2 mol B混合,测得不同时刻的压强关系如下:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 |
总压强p/MPa | 20 | 18 | 16.5 | 15 | 12.5 | 12.5 |
①计算反应到2h时v(A)=__________
②计算平衡时B的转化率为 __________,该温度下反应的平衡常数值________。
③由总压强p和起始压强p0表示反应体系的总物质的量n(总)和生成物C的物质的量n(C),则 n(总 )=________mol,n(C)=___________mol,反应物A的转化率α(A)的表达式为_______________________。
【答案】放热 ![]() C b 350℃ 0.175mol/(L·h)或0.0029mol/(L·min) 75% 2.4或
C b 350℃ 0.175mol/(L·h)或0.0029mol/(L·min) 75% 2.4或![]() 4P/P0 2-
4P/P0 2-![]() (1-
(1-![]() )×100%
)×100%
【解析】
(1)由题中数据可知,升高温度平衡常数减小,该反应为放热反应,根据平衡常数定义书写该反应的平衡常数表达式;
(2)达到平衡状态时正逆反应速率相等,各物质的浓度保持不变,以此判断;
(3)根据化学反应速率和化学平衡的影响因素进行判断;
(4)利用题中数据计算平衡常数,与表中数据对比判断反应温度;
(5)根据三段式结合气体压强比等于物质的量之比进行计算。
(1)由题中数据可知,升高温度平衡常数减小,说明升高温度平衡逆向移动,则该反应为放热反应,生成物D为固体,所以平衡常数表达式为![]() ;
;
故答案为:![]() ;
;
(2)①该反应为反应前后气体的物质的量不等的可逆反应,容器中压强不变,说明正逆反应速率相等,反应达到平衡状态,故①选;
②混合气体中c(A)不变,说明正逆反应速率相等,反应达到平衡状态,故②选;
③反应达到平衡状态时,用不同物质表示的正逆反应速率之比等于化学计量数之比,即v正(B)=2v逆(A),则2v正(B)=v逆(A) 不能说明反应达到平衡状态,故③不选;
④该反应在恒容绝热的密闭容器中进行,容器内温度不变,说明反应达到平衡状态,故④选;
⑤生成物D为固体,在恒容的密闭容器中,容器的体积不变,但气体的质量为变量,所以容器中混合气体的密度为变量,混合气体的密度不变,说明反应达到平衡状态,故⑤选;
⑥该反应为反应前后气体的物质的量不等的可逆反应,生成物D为固体,气体的质量为变量,所以平均摩尔质量为变量,平均摩尔质量不变,说明反应达到平衡状态,故⑥选;
⑦c(A):c(b):c(c)=1:2:1,不能说明各物质的浓度不变,不能说明反应达到平衡状态,故⑦不选;
答案选:C;
(3)a.在恒压下中再充入He,容器的体积增大,各物质的浓度减小,化学反应速率减小,故a不选;
b.向恒容体积再充入A,A的物质的量浓度增大,化学反应速率增大且平衡向正向移动,B的转化率增大,故b选;
c.改变反应的催化剂,可以改变化学反应速率,但平衡不移动,B的转化率不变,故c不选;
d.该反应为放热反应,升高温度可以加快化学反应速率,但平衡逆向移动,B的转化率减小,故d不选;
(4)若某温度下,该反应达到平衡时测得反应物与生成物的浓度为c(A)=0.4 mol·L-1、c(B)=0.4 mol·L-1、c(C)=0.8 mol·L-1,平衡常数K=![]() =12.5,由表中数据可知,此时的温度为350℃,
=12.5,由表中数据可知,此时的温度为350℃,
故答案为:350℃;
(5)①某温度下,在体积固定的1L的密闭容器中将2 mol A和2 mol B混合,气体的压强比等于气体的物质的量之比,根据三段式有:
A(g)+ 2B(g)![]() C(g)+2D(s)
C(g)+2D(s)
起始(mol)2 2 0
转化(mol)x 2x x
2h(mol) 2-x 2-2x x
则2h时:![]() =
=![]() ,解得x=0.35mol,所以反应到2h时v(A)=
,解得x=0.35mol,所以反应到2h时v(A)=![]() =0.175mol/(L
=0.175mol/(L![]() h),
h),
故答案为:0.175mol/(L![]() h);
h);
②由表中数据可知,反应达到平衡时,容器内压强为12.5,与上述同样方法计算,得出达到平衡时A转化了0.75mol、B转化了1.5mol、C生成了0.75mol,
则平衡时B的转化率为 ![]() ×100%=75%,
×100%=75%,
该温度下反应的平衡常数K=![]() =2.4,
=2.4,
故答案为:75%;2.4;
③依据压强比等于物质的量之比得![]() =
=![]() ,n(总)= 4P/P0mol;
,n(总)= 4P/P0mol;
结合三行式![]() =
=![]() ,解得n(C)= (2-
,解得n(C)= (2-![]() )mol;
)mol;
转化A的物质的量为(2-![]() )mol,反应物A的转化率α(A)=
)mol,反应物A的转化率α(A)=![]() ×100%=(1-
×100%=(1-![]() )×100%,
)×100%,
故答案为:(1-![]() )×100%。
)×100%。

【题目】温度为T时,向2.0L恒容密闭容器中充入1.0molA,反应A(g)===B(g)+C(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
t/s | 0 | 50 | 150 | 250 | 350 |
n(B)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A. 反应在前50s的平均速率v(B)=0.0032mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(B)=0.11mol·L-1,则反应的ΔH<0
C. 相同温度下,起始时向容器中充入1.0mol A、0.20mol B和0.20mol C,反应达到平衡前v正<v逆
D. 相同温度下,起始时向容器中充入2.0mol B和2.0mol C,达到平衡时,B的转化率大于80%