��Ŀ����
����Ŀ���¶�ΪTʱ����2.0L�����ܱ������г���1.0molA����ӦA(g)===B(g)+C(g)����һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±�������˵����ȷ����
t/s | 0 | 50 | 150 | 250 | 350 |
n(B)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A. ��Ӧ��ǰ50s��ƽ������v(B)=0.0032mol��L-1��s-1
B. ���������������䣬�����¶ȣ�ƽ��ʱc(B)=0.11mol��L-1����Ӧ����H<0
C. ��ͬ�¶��£���ʼʱ�������г���1.0mol A��0.20mol B��0.20mol C����Ӧ�ﵽƽ��ǰv����v��
D. ��ͬ�¶��£���ʼʱ�������г���2.0mol B��2.0mol C���ﵽƽ��ʱ��B��ת���ʴ���80%
���𰸡�D
��������
A. ��Ӧ��ǰ50s��ƽ������v(B)=![]() =
=![]() =0.0016mol��L-1��s-1����A����
=0.0016mol��L-1��s-1����A����
B. ��Ӧ�ﵽƽ��ʱB�����ʵ���Ũ��Ϊ0.20mol��2.0L=0.10mol/L�����������������䣬�����¶ȣ�ƽ��ʱc(B)=0.11mol��L-1��˵�������¶�ƽ�������ƶ�������ӦΪ���ȷ�Ӧ���÷�Ӧ����H��0����B����
C. �¶�ΪTʱ����2.0L�����ܱ������г���1.0molA����ӦA(g) ![]() B(g)+C(g)����һ��ʱ���ﵽƽ�⣬��������ʽ���У�
B(g)+C(g)����һ��ʱ���ﵽƽ�⣬��������ʽ���У�
A(g) ![]() B(g)+C(g)
B(g)+C(g)
��ʼ��mol/L�� 0.5 0 0
ת����mol/L��0.1 0.1 0.1
ƽ�⣨mol/L��0.4 0.1 0.1
ƽ�ⳣ��K=![]() =0.025����ͬ�¶��£���ʼʱ�������г���1.0mol A��0.20mol B��0.20mol C��Ũ����Qc=
=0.025����ͬ�¶��£���ʼʱ�������г���1.0mol A��0.20mol B��0.20mol C��Ũ����Qc=![]() =0.02��K��˵����Ӧ�����������Ӧ�ﵽƽ��ǰv����v������C����
=0.02��K��˵����Ӧ�����������Ӧ�ﵽƽ��ǰv����v������C����
D. ����ͬ�¶Ⱥͺ��ݵ�����������ʼʱ�������г���1.0mol B��1.0mol C����ԭƽ���Ч�������������֪��ƽ��ʱB�����ʵ���Ϊ0.1mol/L��2L=0.2mol����B��ת����Ϊ(1.0mol��0.2mol)��1mol��100%=80%����ͬ�¶��£���ʼʱ�������г���2.0mol B��2.0mol C���൱����ʼʱ�������г���2.0mol A����ԭƽ����ȣ��൱������ѹǿ��ƽ�������ƶ���B��ת����������ﵽƽ��ʱ��B��ת���ʴ���80%����D��ȷ����ѡD��

 ����ѵ�����⿼ϵ�д�
����ѵ�����⿼ϵ�д� �������ϵ�д�
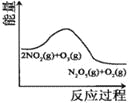
�������ϵ�д�����Ŀ���������������������������������ӦΪ��2NO2(g)+O3(g)![]() N2O5(g)+O2(g)����Ӧ�ں����ܱ������н��У������ɸ÷�Ӧ���ͼ���������ж���ȷ���ǣ� ��
N2O5(g)+O2(g)����Ӧ�ں����ܱ������н��У������ɸ÷�Ӧ���ͼ���������ж���ȷ���ǣ� ��
A | B | C | D |
|
|
|
|
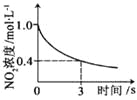
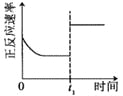
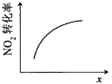
�����¶ȣ� | 0��3s�ڣ���Ӧ����Ϊ�� | t1ʱ����������� | ��ƽ��ʱ�����ı�x����xΪc(O2) |
����Ŀ����ѧƽ��״̬��������III������������±���
��� | ��ѧ����ʽ | ƽ�ⳣ�� | �¶� | |
979K | 1173K | |||
�� | Fe(s)+CO2(g) FeO(s)+ CO(g) | K1 | 1.47 | 2.15 |
�� | CO(g)+H2O(g) CO2(g)+H2(g) | K2 | 1.62 | b |
�� | Fe(s)+ H2O(g) FeO(s) +H2(g) | K3 | a | 1.68 |
����������Ϣ�жϣ����н�����ȷ����
A.a<b
B.��Ӧ����III��Ϊ���ȷ�Ӧ
C.�����¶�ƽ��״̬III������Ӧ�����ƶ�
D.����ѹǿ��״̬������Ӧ���������淴Ӧ���ʼ�С��ƽ�ⲻ�ƶ�