题目内容
2.实验室要配制2mol/L稀硫酸250mL.(1)需要量取质量分数为98%密度为1.84g/mL的浓硫酸27.2 mL.
(2)配制过程中需要下列仪器中的B、C、E、F、H(填选项的标号).
A.托盘天平 B.烧杯 C.量筒 D.烧瓶 E.玻璃棒 F.胶头滴管 G.试管 H.250mL容量瓶
(3)下列实验操作中,按先后顺序排列为D、C、A、E、B、F、H、G.
A.将稀释、冷却后的硫酸沿玻璃棒注入250mL容量瓶中.
B.将洗涤液也注入容量瓶中,轻轻摇动容量瓶,使溶液混合均匀.
C.将量取的浓硫酸沿玻璃棒缓慢注入烧杯中,搅拌并冷却至室温.
D.向烧杯中加入约100mL蒸馏水.
E.用适量蒸馏水洗涤烧杯2~3次.
F.向容量瓶中加蒸馏水到液面接近刻度1cm~2cm处.
G.盖上瓶塞,并反复倒转摇匀.
H.用胶头滴管加蒸馏水到瓶颈刻度处.
(4)在配制过程中,如果出现下列情况,将对所配溶液的物质的量浓度有何影响?(填“偏高”、“偏低”或“无影响”)用量筒量取浓硫酸时,仰视量筒进行读数偏高.定容时,仰视观察容量瓶刻度线偏低.
分析 (1)依据C=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度,依据溶液稀释前后溶质的物质的量不变计算需要浓硫酸体积;
(2)依据配制步骤选择合适的仪器;
(3)依据配制一定物质的量浓度溶液的一般步骤排序;
(4)分析不当操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
解答 解:(1)98%密度为1.84g/mL的浓硫酸物质的量浓度=$\frac{1000×1.84×98%}{98}$=18.4mol/L,设需要浓硫酸体积为V,依据溶液稀释前后溶质的物质的量不变,V×18.4mol/L=250mL×2mol/L,解得V=27.2mL;
故答案为:27.2;
(2)配制250ml 2mol/L的稀硫酸步骤为:计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,需要的仪器有:量筒、玻璃棒、胶头滴管、烧杯、250mL容量瓶,
故答案为:B、C、E、F、H;
(3)配制一定物质的量浓度溶液的一般步骤:计算、量取(称量)、稀释(溶解)、冷却、移液、洗涤、定容、摇匀、装瓶;
所以正确的顺序为:D、C、A、E、B、F、H、G;
故答案为:D、C、A、E、B、F、H、G;
(4)用量筒量取浓硫酸时,仰视量筒进行读数,导致量取的硫酸的物质的量偏高,溶液浓度偏高;
定容时,仰视观察容量瓶刻度线,导致溶液体积偏大,溶液浓度偏低;
故答案为:偏高 偏低.
点评 本题考查了配制一定物质的量浓度溶液,明确配制原理和步骤是解题关键,题目难度不大.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
12.实验是化学学习的基础.下列实验叙述正确的是( )
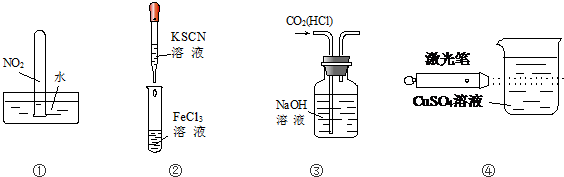

| A. | 实验①试管最终会充满水 | |
| B. | 实验②试管中溶液变为血红色 | |
| C. | 可用实验③装置除去CO2气体中含有的少量HCl杂质 | |
| D. | 实验④可观察丁达尔现象 |
10.PASS是新一代高效净水剂,它由X、Y、Z、W、R五种短周期元素组成,五种元素原子序数依次增大.X原子是所有原子中半径最小的,Y、R同主族,Z、W、R同周期,Y原子的最外层电子数是次外层的3倍,Z是常见的金属,电子层数等于主族序数,W单质是人类将太阳能转变为电能的常用材料.下列说法正确的是( )
| A. | 原子半径按X、Y、Z、R、W的顺序依次增大 | |
| B. | 熔沸点:X2R>X2Y | |
| C. | Z与Y形成的化合物可作为耐高温材料 | |
| D. | WY2能与碱反应,但不能与任何酸反应 |
17.下列关于二氧化硅的说法中,不正确的是( )
| A. | 能与水反应 | B. | 能与NaOH溶液反应 | ||
| C. | 能与氢氟酸反应 | D. | 能与氧化钙反应 |
14.下列四个能级中,能量最高,电子最后填充的是( )
| A. | 3s | B. | 3p | C. | 3d | D. | 4s |
12.下列说法中不正确的是( )
| A. | 硫酸氢钠属于酸 | |
| B. | 硫酸氢钠属于盐 | |
| C. | 硫酸氢钠属于电解质 | |
| D. | 硫酸氢钠溶液跟锌单质反应生成氢气 |
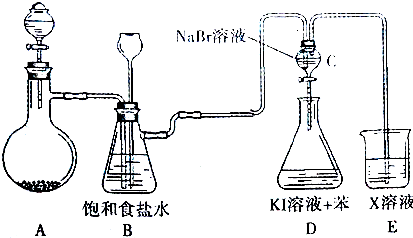
 .
.