题目内容
7.如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备巳略)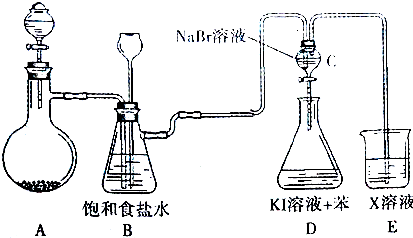
(1)装置A中的反应原理是2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O,在标准状况下若生成2.24LCl2时,转移的电子数目是0.2mol.
(2)装置B除了做安全瓶外,还可以起到的作用是吸收氯气中的氯化氢.
(3)设计装置C、D的目的是比较氯、溴、碘的非金属性相对强弱.当向C中缓缓通入少量氯气时,可以看到无色溶液逐渐变为橙黄色;然后再打开分液漏斗的活塞,将装置C中少量溶液加入装置D中,振荡.观察到的现象是溶液分层,上层为紫红色.由上述现象可得出的结论:氯气的氧化性强于溴,溴的氧化性强于碘
(4)有人提出,装置E中X溶液可用足量的Na2SO3溶液吸收余氯,试写出相应的离子反应方程式:Cl2+SO32-+H2O=SO42-+2H++Cl-.
分析 (1)依据方程式2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O,分析元素化合价升降,找出生成5mol氯气转移电子数,据此解答;
(2)浓盐酸易挥发,制备的氯气中含有氯化氢,氯化氢易溶于饱和食盐水,氯气在饱和食盐水中溶解度不大,据此解答;
(3)依据氯气的氧化性强于溴,溴的氧化性强于碘解答;
(4)氯气具有强的氧化性,能够氧化亚硫酸钠.
解答 解:(1)反应中Mn元素化合价降低,KMnO4被还原,则为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,根据方程式可知当有16molHCl参加反应,有10molHCl被氧化,生成5mol氯气,转移电子数10mol,在标准状况下若生成2.24LCl2(0.1mol)时,转移电子数为0.2mol;
故答案为:0.2mol;
(2)浓盐酸易挥发,制备的氯气中含有氯化氢,氯化氢易溶于饱和食盐水,氯气在饱和食盐水中溶解度不大,可以用饱和食盐水除去氯气中的氯化氢;
故答案为:除去氯气中的氯化氢;
(3)氯气的氧化性强于溴,能够与溴化钠反应制取溴,溴的氧化性强于碘,能够与碘化钾反应生成单质碘,碘单质溶于苯呈紫红色,振荡分层,苯层在上层;
故答案为:溶液分层,上层为紫红色;氯气的氧化性强于溴,溴的氧化性强于碘;
(4)氯气与亚硫酸钠反应生成硫酸钠和盐酸,离子方程式:Cl2+SO32-+H2O=SO42-+2H++Cl-,
故答案为:Cl2+SO32-+H2O=SO42-+2H++Cl-.
点评 本题考查了氯气实验室制取,氯气化学性质检验,明确实验原理及各装置作用是解题关键,题目难度不大.

练习册系列答案
相关题目
18.下列说法正确的是( )
| A. | 废旧电池不能混到生活垃圾中,可以用焚烧的方法处理 | |
| B. | 防腐剂能延长食品的保存期,所以应大量使用防腐剂 | |
| C. | 84消毒液属于含氯消毒剂,和食品一样有保质期 | |
| D. | 臭氧具有优异的杀菌消毒功能,在居室内保持低浓度的臭氧是有益的 |
15.NO对于心脑血管系统功能的改善具有重要作用.下列关于NO的描述不正确的是( )
| A. | 难溶于水 | |
| B. | 可由氮气和氧气在放电条件下反应生成 | |
| C. | 常温下能与氧气化合 | |
| D. | 红棕色气体 |
19.下列说法或表示方法中正确的是( )
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由C(金刚石)→C(石墨);△H=-1.9KJ/mol 可知,金刚石比石墨稳定 | |
| C. | 在101Kpa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l);△H=+285.8KJ/mol | |
| D. | 稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-53.7KJ/mol,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于53.7KJ/mol |
17.用NA表示阿伏伽德罗常数的值,下列判断正确的是( )
| A. | 8g O2含有4NA个电子 | |
| B. | 1L 1mol•L-1的H2SO4溶液所含氧原子数为4NA | |
| C. | 标准状况下,22.4L O2和CO2的混合气体所含原子数为2.5NA | |
| D. | 标准状况下,22.4L CCl4含有NA个分子 |
