题目内容
【题目】某合金废料主要含铁、铜、铝,为从合金废料中得到Fe2O3、Al2O3和金属Cu等产品,某化学兴趣小组按如下工艺流程进行实验(杂质不与稀硫酸反应)。

请回答下列问题:
(1)固体A主要含有的物质是________。
(2)B到C发生反应的离子方程式为________,溶液C中的阳离子主要有________。
(3)若D为NaOH,则溶液E中铝元素的存在形式是________(填化学式)。
(4)灼烧沉淀F时所用主要仪器之一是________(填序号)。
A.蒸发皿 B.烧杯 C.坩埚 D.试管
(5)氮化铝(AlN)陶瓷是一种具有广阔开发前景的高温结构材料,具有高导热率、高电绝缘性、高强度、高硬度、耐腐蚀等优良性能,工业上可通过Al2O3、碳和N2在高温条件下反应得到,同时生成一种常见气体G,若该反应每转移3.01╳1023个电子,有0.25mol气体G生成,则该反应的化学方程式为_________。在工业上Al2O3的用途还有________(任填一种)。
【答案】Cu或铜 Cl2+2Fe2+=2Cl-+2Fe3+ Fe3+、A13+和H+ NaA1O2 C Al2O3 + N2 + 3C![]() 2AlN + 3CO 冶炼金属铝或作防火材料
2AlN + 3CO 冶炼金属铝或作防火材料
【解析】
铁、铝和硫酸反应生成硫酸亚铁、硫酸铝,铜和硫酸不反应,滤液B中含有硫酸亚铁、硫酸铝,通入足量氯气,Fe2+被氧化为Fe3+,加入过量氢氧化钠溶液,生成氢氧化铁沉淀和偏铝酸钠,偏铝酸钠溶液中通入足量二氧化碳生成氢氧化铝沉淀。
(1) 铁、铝和硫酸反应生成硫酸亚铁、硫酸铝,铜和硫酸不反应,所以固体A主要含有的物质是Cu;
(2) 滤液B中含有硫酸亚铁、硫酸铝和硫酸,通入足量氯气,Fe2+被氧化为Fe3+,发生反应的离子方程式为Cl2+2Fe2+=2Cl-+2Fe3+;溶液C中的阳离子主要有Fe3+、A13+和H+;
(3) 若D为NaOH,A13+和过量氢氧化钠反应生成偏铝酸钠,则溶液E中铝元素的存在形式是NaA1O2;
(4)在坩埚中灼烧固体物质,灼烧氢氧化铁沉淀时所用主要仪器之一是坩埚,选C;
(5)工业上可通过Al2O3、碳和N2在高温条件下反应得到AlN,同时生成一种常见气体G,若该反应每转移3.01╳1023个电子,有0.25mol气体G生成,说明碳的化合价升高为+2,则G是CO,则该反应的化学方程式为Al2O3+ N2+ 3C![]() 2AlN + 3CO;电解熔融氧化铝冶炼金属铝,在工业上用Al2O3冶炼金属铝。
2AlN + 3CO;电解熔融氧化铝冶炼金属铝,在工业上用Al2O3冶炼金属铝。

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案【题目】将物质X逐渐加入Y溶液中,生成沉淀物质的量n2与所加X的物质的量n1的关系如图所示。符合图所示情况的是
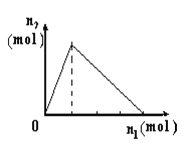
A | B | C | D | |
X | NaOH | AlCl3 | HCl | NaAlO2 |
Y | AlCl3 | NaOH | NaAlO2 | HCl |
A. A B. B C. C D. D