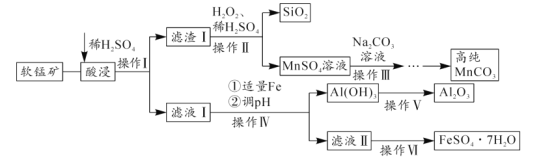
题目内容
【题目】常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液,有关粒子的物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。下列说法正确的是
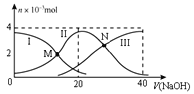
A. M点溶液中:2c(HA-)+c(A2-)=0.2 mol/L
B. N点溶液呈酸性,则c(Na+) < 3c(HA-)
C. 若N点溶液pH =5,则H2A的Ka2数量级为104
D. V(NaOH)=20mL时,溶液中:c(H+) < c(OH-)
【答案】B
【解析】
根据图象知,H2A溶液中存在H2A分子,说明H2A部分电离,所以H2A为弱酸,NaOH溶液体积为20 mL时,发生反应为NaOH+H2A═NaHA+H2O,溶液中的溶质主要为NaHA,HA-电离程度大于水解程度,溶液显酸性,NaOH溶液体积为40mL时,发生反应为NaOH+NaHA═Na2A+H2O,反应后得到溶液为Na2A溶液,A2-离子水解溶液显碱性。
A项、由图可知,M点溶液中c(H2A)= c(HA-),由物料守恒可知c(H2A)+c(HA-)+ c(A2-)=![]() <0.2 mol/L,则2c(HA-)+c(A2-) <0.2 mol/L,故A错误;
<0.2 mol/L,则2c(HA-)+c(A2-) <0.2 mol/L,故A错误;
B项、N点溶液中c(HA-)= c(A2-),溶液中存在电荷守恒关系c(Na+)+ c(H+)= c(OH-)+ c(HA-)+2 c(A2-),因溶液呈酸性,溶液中c(OH-)< c(H+),则c(Na+) < 3c(HA-),故B正确;
C项、N点溶液中c(HA-)= c(A2-),H2A的Ka2= = c(H+)=1×10—5,Ka2数量级为105,故C错误;
= c(H+)=1×10—5,Ka2数量级为105,故C错误;
D项、NaOH溶液体积为20 mL时,恰好发生反应为NaOH+H2A═NaHA+H2O,溶液中的溶质为NaHA,由图像可知,此时溶液中n(A2-)>n(H2A),说明HA-电离程度大于水解程度,溶液显酸性,故溶液中c(OH-)< c(H+),D错误。
故选B。

【题目】下列实验操作、现象和所得结论都正确的是
选项 | 实验 | 现象 | 结论 |
A | 向滴有酚酞的 Na2CO3 溶液中加入少量氯化钡固体,振荡 | 溶液红色变浅 | Na2CO3溶液存在水解平衡 |
B | 向X溶液中滴加几滴新制氯水,振 荡 ,再加入少量KSCN溶液 | 溶液变为红色 | X溶液中一定含有Fe2+ |
C | 检验食盐是否加碘( KIO3), 取少量食盐溶于水,用淀粉碘化钾试纸检验 | 试纸不变蓝 | 该食盐不含有KIO3 |
D | 向蛋白质溶液中加入CuSO4或( NH4)2 SO4 的饱和溶液 | 均有沉淀生成 | 蛋白质均发生了盐析 |
A.AB.BC.CD.D