题目内容
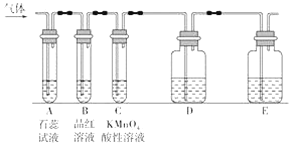
【题目】某课外小组设计了下图所示的实验装置(图中固定装置已略去),进行SO2性质的研究。
(1)从物质分类的角度,SO2属于____(填“酸性”或“碱性”)氧化物。
①图中D装置可用来验证SO2具有该性质,其中所加入的试剂是________________。
②当向该装置通入SO2时,A中实验现象为_________,用化学用语解释其原因___________。
(2)从元素化合价的角度分析,SO2具有___性。
①当向该装置通入SO2一段时间后,可观察C中实验现象为___,说明SO2具有_____性。
②如验证SO2还具有另一方面的性质,可选择的药品是___,实验现象__________。
A.过氧化氢 B.浓硫酸C.氯水 D.硫化钠溶液
(3)B中的品红溶液现象是___________,证明SO2具有_________性。
(4)多余的SO2一般用氢氧化钠溶液吸收,反应的离子方程式_________________。
【答案】酸性 滴加酚酞的NaOH稀溶液 紫色石蕊溶液变红 H2O+SO2![]() H2SO3 氧化性和还原 溶液褪色 还原 D 有淡黄色沉淀生成 褪色 漂白 SO2+2OH-=SO32—+H2O
H2SO3 氧化性和还原 溶液褪色 还原 D 有淡黄色沉淀生成 褪色 漂白 SO2+2OH-=SO32—+H2O
【解析】
(1)二氧化硫为酸性氧化物,可在A中使石蕊试液变红色,二氧化硫具有漂白性,B中品红褪色,具有还原性,可在C中与高锰酸钾发生氧化还原反应,高锰酸钾溶液褪色,检验二氧化硫的酸性,可在D中用滴加酚酞的NaOH稀溶液检验,E应为尾气处理装置;
(2) 从元素化合价的角度分析SO2的性质,二氧化硫中S元素化合价为+4价,具有还原性和氧化性,可与高锰酸钾、硫化钠等溶液反应,以此解答该题;
(3) SO2具有漂白性,能使品红褪色;
(4) SO2是酸性氧化物,溶于氢氧化钠溶液生成Na2SO3和水。
(1) 二氧化硫能和碱反应生成盐和水,属于酸性氧化物;
①能和碱反应生成盐和水的氧化物是酸性氧化物,因此要验证二氧化硫属于酸性氧化物,必须和碱反应,例如二氧化硫和氢氧化钠溶液反应生成亚硫酸钠和水.但亚硫酸钠溶液和氢氧化钠溶液都是无色溶液,不能观察到明显的实验现象,所以可向溶液中加入酚酞试液检验亚硫酸钠的生成,即D中盛放的液体是滴加酚酞的氢氧化钠稀溶液;
②二氧化硫和水反应生成亚硫酸,反应方程式为H2O+SO2![]() H2SO3。亚硫酸能电离出氢离子而使其溶液呈酸性,酸能使紫色石蕊试液变红色;
H2SO3。亚硫酸能电离出氢离子而使其溶液呈酸性,酸能使紫色石蕊试液变红色;
(2) 二氧化硫中硫元素的化合价为+4价,处于中间价态,既有氧化性也有还原性;
①酸性高锰酸钾具有强氧化性,能氧化二氧化硫生成硫酸,则C中实验现象为溶液褪色,说明SO2具有还原性;
②要证明二氧化硫的氧化性,则必须和还原性物质发生氧化还原反应.
A.过氧化氢具有氧化性,能氧化二氧化硫,故A错误;
B.浓硫酸具有强氧化性,且和二氧化硫不反应,故B错误;
C.氯水具有强氧化性,能氧化二氧化硫,故C错误;
D.硫化钠具有还原性,能被二氧化硫氧化生成单质S,因此可以验证SO2的氧化性,故D正确;
故答案为:D;可观察到的实验现象为有淡黄色沉淀生成;
(3)B中的品红溶液褪色,证明SO2具有漂白性;
(4) SO2是酸性氧化物,溶于氢氧化钠溶液生成Na2SO3和水,反应的离子方程式SO2+2OH-=SO32—+H2O。

 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案【题目】25 ℃时,0.1 mol·L-1HA溶液中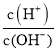 =108,0.01 mol·L-1BOH溶液pH=12。请回答下列问题:
=108,0.01 mol·L-1BOH溶液pH=12。请回答下列问题:
(1)HA的电离常数Ka为________,BOH是________(填“强电解质”或“弱电解质”)。
(2)pH相等的BOH溶液与BA溶液,分别加热到相同的温度后BOH溶液的pH________(填“>”“=”或“<”)BA溶液的pH。
(3)已知碳酸的Ka1=4.3×10-7,Ka2=5.6×10-11,向等浓度的Na2CO3和NaA的溶液中滴加盐酸直至过量,则与H+作用的粒子依次为___________________。
(4)25 ℃,两种酸的电离平衡常数如下表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO3-的电离平衡常数表达式K=___________________。
②0.10 mol·L-1 NaHSO3溶液中离子浓度由大到小的顺序为_____________________。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为______________________。