题目内容
5.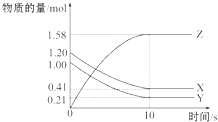 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列叙述中正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列叙述中正确的是( )| A. | 从反应开始到10 s时,用Z表示的反应速率为0.158 mol•L-1•s-1 | |
| B. | 10s后,该反应停止进行 | |
| C. | 反应的化学方程式为2X(g)+Y(g)?2Z(g) | |
| D. | 从反应开始到10 s时,平均反应速率v(X)=v(Y)=0.039 5 mol•L-1•s-1 |
分析 根据图象的曲线变化判断物质的量的变化以及反应速率、转化率的计算,根据参加反应的物质的物质的量之比等于化学计量数之比书写化学方程式;
A、反应速率V=$\frac{\frac{△n}{V}}{△t}$计算得到;
B、反应达到平衡状态为动态平衡;
B、计算物质变化的物质的量,变化的物质的量之比等于化学方程式计量数之比;
D、速率之比等于化学方程式计量数之比,依据A计算得到Z的反应速率换算得到XY的反应速率.
解答 解:A.反应开始到10s,用Z表示的反应速率$\frac{\frac{1.58mol}{2L}}{10s}$=0.079mol/(L•s),故A错误;
B.反应开始到10s,物质浓度不变,反应达到平衡状态,正逆反应速率相同,但不为0,反应仍在进行,故B错误;
C.由图象可以看出,反应中x、Y的物质的量减少,应为反应物,z的物质的量增多,应为生成物,当反应进行到10s时,△n(X)=0.79mol,△n(Y)=0.79mol,△n(Z)=1.58mol,则△n(X):△n(Y):△n(Z)=1:1:2,参加反应的物质的物质的量之比等于化学计量数之比,则反应的方程式为X(g)+Y(g)?2Z(g),故C错误;
D.反应速率之比等于化学方程式计量数之比,从反应开始到10 s时,平均反应速率v(X)=v(Y)=$\frac{1}{2}$V(Z)=0.039 5 mol•L-1•s-1,故D正确;
故选D.
点评 本题考查化学平衡图象问题,题目难度不大,解题时注意分析图象中各物理量的变化曲线,把握相关物理量的计算.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案
相关题目
15. 将等物质的量的金属Na、Mg、Al分别与100mL 2mol•L-1的盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则下列说法错误的是( )
将等物质的量的金属Na、Mg、Al分别与100mL 2mol•L-1的盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则下列说法错误的是( )
 将等物质的量的金属Na、Mg、Al分别与100mL 2mol•L-1的盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则下列说法错误的是( )
将等物质的量的金属Na、Mg、Al分别与100mL 2mol•L-1的盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则下列说法错误的是( )| A. | x=2.24 | B. | 钠的物质的量为0.2 mol | ||
| C. | 反应时,Na、Mg、Al均过量 | D. | 曲线b为Mg与盐酸反应的图象 |
16.下列各组有机物只用一种试剂无法鉴别的是( )
| A. | 苯、甲苯、环己烷 | B. | 苯、苯酚、己烯 | ||
| C. | 乙醇、甲苯、硝基苯 | D. | 乙醇、乙醛、乙酸 |
13.化学实验在学科中有举足轻重的作用,结合下列实验的图示分析相关的描述正确的是( )
| A. |  根据用电器(G)中指针的偏转方向可比较Zn、Cu的金属的氧化性 | |
| B. |  根据右侧小试管中液面的变化,可以判断铁钉发生了析氢腐蚀 | |
| C. |  测定中和热 | |
| D. |  根据两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)可以判断2NO2(g)?N2O4(g)是一个放热反应 |
20.下列说法中,正确的是( )
| A. | 非金属元素之间形成的化合物一定是共价化合物 | |
| B. | 在气态单质分子中不一定存在着共价键 | |
| C. | 两个原子或多个原子之间的相互作用叫化学键 | |
| D. | 离子化合物中一定含有离子键,不存在共价键 |
10.下列各组物质中,化学键类型相同的是( )
| A. | HCl和KCl | B. | H2S和Na2S | C. | CH4和H2O | D. | H2SO4和Na2SO4 |
17.2010年11月12日至27日广州成功举办了第16届亚运会.广州采取了一系列节能减排、改善环境质量的措施.下列说法错误的是( )
| A. | 发展核能发电,以减少火力发电带来的SO2和CO2的排放问题 | |
| B. | 发展低碳经济,利用太阳能、风能实现城市照明 | |
| C. | 推行“限塑令”,研发用二氧化碳合成聚碳酸酯类可降解塑料 | |
| D. | 使用填埋法或焚烧法处理未经分类的生活垃圾 |
14.磷在自然界常以难溶于水的磷酸盐如Ca3(PO4)2等形式存在.它的单质和化合物有着广泛的应用.
(1)2P(s)+3Cl2(g)═2PCl3(g)△H=-612kJ/mol
P(s)+5/2Cl2(g)═PCl5(g)△H=-399kJ/mol
写出PCl5分解成PCl3和Cl2的热化学方程式是PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJ•mol-1.
(2)PCl5分解成PCl3和Cl2的反应是可逆反应.T℃时,向2.0L恒容密闭容器中充入1.0mol PCl5,经过250s达到平衡.反应过程中测定的部分数据见下表:
反应在50~150s 内的平均速率v(PCl3)=1.5×10-4mol/(L•s).
(1)2P(s)+3Cl2(g)═2PCl3(g)△H=-612kJ/mol
P(s)+5/2Cl2(g)═PCl5(g)△H=-399kJ/mol
写出PCl5分解成PCl3和Cl2的热化学方程式是PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJ•mol-1.
(2)PCl5分解成PCl3和Cl2的反应是可逆反应.T℃时,向2.0L恒容密闭容器中充入1.0mol PCl5,经过250s达到平衡.反应过程中测定的部分数据见下表:
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
15.下列事实不能用电化学原理解释的是( )
| A. | 铁片在潮湿的环境中生锈 | |
| B. | 远洋海轮的尾部装上一定数量的锌板 | |
| C. | 银制器皿露置在空气中发黑 | |
| D. | 用锌与硫酸制氢气时,往硫酸中滴少量硫酸铜 |