题目内容
15. 将等物质的量的金属Na、Mg、Al分别与100mL 2mol•L-1的盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则下列说法错误的是( )
将等物质的量的金属Na、Mg、Al分别与100mL 2mol•L-1的盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则下列说法错误的是( )| A. | x=2.24 | B. | 钠的物质的量为0.2 mol | ||
| C. | 反应时,Na、Mg、Al均过量 | D. | 曲线b为Mg与盐酸反应的图象 |
分析 由于最后生成的气体量相同,所以这些金属置换出的氢气量相等,即等物质的量的三种金属失去了相同数量的电子,而若盐酸过量的话,这些金属失去的电子数应该是不一样的,比值应是1:2:3,故推断出盐酸不可能过量,但可能刚好和Na反应完全,此时Na完全反应而Mg、Al还有剩余,由此分析.
解答 解:由于最后生成的气体量相同,所以这些金属置换出的氢气量相等,即等物质的量的三种金属失去了相同数量的电子,而若盐酸过量的话,这些金属失去的电子数因该是不一样的,比值应是1:2:3,故推断出盐酸不可能过量,但可能刚好和Na反应完全,此时Na完全反应而Mg、Al还有剩余,
A、由于酸不足,所以生成氢气的量为:n(H2)=$\frac{1}{2}$n(HCl)=$\frac{0.1×2}{2}$=0.1mol,所以标况下的体积为2.24L,故A正确;
B、生成0.1mol的氢气需0.2mol的钠,故B正确;
C、Na不可能过量,即使过量也要与溶剂水反应,故C错误;
D、按照金属活动性顺序,Na>Mg>Al 故中间那条线是Mg与盐酸反应的图象,故D正确;
故选C.
点评 本题考查钠的性质,注意钠和水反应的特点,根据物质的量的大小可与酸、水反应的特点比较生成氢气的多少,难度不大.

练习册系列答案
相关题目
11.以下关于化学实验中“先与后”的说法中正确的是( )
①加热试管时,先均匀加热,后局部加热;
②用排水法收集气体时,先移出导管后撤酒精灯;
③制取物质时,先检查装置气密性后装药品;
④使用容量瓶、分液漏斗、滴定管前,先检查是否漏水后洗涤干净;
⑤做H2还原CuO实验时先加热CuO后通H2;反应完毕后,先撤酒精灯待试管冷却后停止通H2.
①加热试管时,先均匀加热,后局部加热;
②用排水法收集气体时,先移出导管后撤酒精灯;
③制取物质时,先检查装置气密性后装药品;
④使用容量瓶、分液漏斗、滴定管前,先检查是否漏水后洗涤干净;
⑤做H2还原CuO实验时先加热CuO后通H2;反应完毕后,先撤酒精灯待试管冷却后停止通H2.
| A. | 除②以外 | B. | 除④以外 | C. | 除⑤以外 | D. | 全部正确 |
3. 某混合溶液中可能含有的离子如下表所示:
某混合溶液中可能含有的离子如下表所示:
为探究其成分,进行了以下探究实验.
(1)探究一:
甲同学取一定量的混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如图所示.
①该溶液中一定不存在的阳离子是Mg2+、Fe3+、Ag+,一定不存在的阴离子是CO32-、AlO2-;含有的阳离子其对应物质的量浓度之比为H+、NH4+、Al3+为2:3:1;
②请写出沉淀减少过程中发生反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(2)探究二:
乙同学检测到该溶液中含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
①当起始至通入Cl2的体积为22.4L时,溶液中发生反应总的离子方程式为4Cl2+2Br-+6I-=8Cl-+Br2+3I2;
②原溶液中Cl-、Br-、I-的物质的量浓度之比为1:2:1.
 某混合溶液中可能含有的离子如下表所示:
某混合溶液中可能含有的离子如下表所示:| 可能大量含有的阳离子 | H+、Ag+、Mg2+、Al3+、NH4+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32-、AlO2- |
(1)探究一:
甲同学取一定量的混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如图所示.
①该溶液中一定不存在的阳离子是Mg2+、Fe3+、Ag+,一定不存在的阴离子是CO32-、AlO2-;含有的阳离子其对应物质的量浓度之比为H+、NH4+、Al3+为2:3:1;
②请写出沉淀减少过程中发生反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(2)探究二:
乙同学检测到该溶液中含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
| Cl2的体积(标准状况) | 11.2L | 22.4L | 28.0L |
| n(Cl-) | 2.5mol | 3.5mol | 4.0mol |
| n(Br-) | 3.0mol | 2.5mol | 2.0mol |
| n(I-) | x mol | 0 | 0 |
②原溶液中Cl-、Br-、I-的物质的量浓度之比为1:2:1.
10.下列事实与推论相符的是( )
| 选项 | 实验事实 | 推论 |
| A | H2O的沸点比H2S的沸点高 | 非金属性:O>S |
| B | 盐酸的酸性比H2SO3的酸性强 | 非金属性:Cl>S |
| C | 钾与水的反应比钠与水的反应更剧烈 | 金属性:Na>K |
| D | HF的热稳定性比HCl的强 | 非金属性:F>Cl |
| A. | A | B. | B | C. | C | D. | D |
20.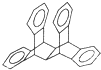 科罗拉多大学的克利斯托(S.Cristol)等人合成了一种有机分子,这种分子让他想起罗马的两面神Janus--罗马的守门神,克利斯托的同事迈金泰(Macintyre)就建议将该分子叫做Janusene.该有机物的结构简式如图所示,下列说法正确的是( )
科罗拉多大学的克利斯托(S.Cristol)等人合成了一种有机分子,这种分子让他想起罗马的两面神Janus--罗马的守门神,克利斯托的同事迈金泰(Macintyre)就建议将该分子叫做Janusene.该有机物的结构简式如图所示,下列说法正确的是( )
 科罗拉多大学的克利斯托(S.Cristol)等人合成了一种有机分子,这种分子让他想起罗马的两面神Janus--罗马的守门神,克利斯托的同事迈金泰(Macintyre)就建议将该分子叫做Janusene.该有机物的结构简式如图所示,下列说法正确的是( )
科罗拉多大学的克利斯托(S.Cristol)等人合成了一种有机分子,这种分子让他想起罗马的两面神Janus--罗马的守门神,克利斯托的同事迈金泰(Macintyre)就建议将该分子叫做Janusene.该有机物的结构简式如图所示,下列说法正确的是( )| A. | 该有机物属于苯的同系物 | |
| B. | 该有机物完全燃烧生成CO2和H2O的物质的量之比为15:11 | |
| C. | 该有机物的一氯代物只有4种 | |
| D. | 该有机物既能发生取代反应又能发生加成反应 |
7.对于放热反应H2+Cl2=2HCl,下列说法正确的是( )
| A. | 产物所具有的总能量高于反应物所具有的总能量 | |
| B. | 反应物所具有的总能量高于产物所具有的总能量 | |
| C. | 断开1mol H-H键和1mol Cl-Cl键所吸收的总能量小于形成1mol H-Cl键所放出的能量 | |
| D. | 该反应中,热能转变为化学能 |
4.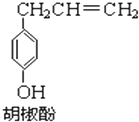 胡椒酚是植物挥发油中的一种成分.关于胡椒酚的下列说法:
胡椒酚是植物挥发油中的一种成分.关于胡椒酚的下列说法:
①该化合物属于芳香烃;
②分子中至少有7个碳原子处于同一平面;
③它的部分同分异构体能发生银镜反应;
④1mol该化合物最多可与2molBr2发生反应;
⑤该化合物可与NaOH和Na2CO3发生反应.其中正确的是( )
 胡椒酚是植物挥发油中的一种成分.关于胡椒酚的下列说法:
胡椒酚是植物挥发油中的一种成分.关于胡椒酚的下列说法:①该化合物属于芳香烃;
②分子中至少有7个碳原子处于同一平面;
③它的部分同分异构体能发生银镜反应;
④1mol该化合物最多可与2molBr2发生反应;
⑤该化合物可与NaOH和Na2CO3发生反应.其中正确的是( )
| A. | ①③⑤ | B. | ①④⑤ | C. | ②③⑤ | D. | ③④⑤ |
5.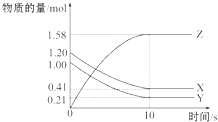 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列叙述中正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列叙述中正确的是( )
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列叙述中正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列叙述中正确的是( )| A. | 从反应开始到10 s时,用Z表示的反应速率为0.158 mol•L-1•s-1 | |
| B. | 10s后,该反应停止进行 | |
| C. | 反应的化学方程式为2X(g)+Y(g)?2Z(g) | |
| D. | 从反应开始到10 s时,平均反应速率v(X)=v(Y)=0.039 5 mol•L-1•s-1 |