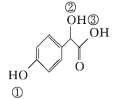
题目内容
【题目】卤族元素包括F、Cl、Br等元素。
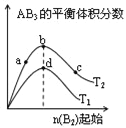
(1)下列曲线表示卤族元素某种性质随核电荷数的变化趋势,正确的是______。

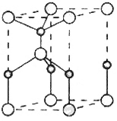
(2)利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,下图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为______,该功能陶瓷的化学式为______。
(3)BCl3和NCl3中心原子的杂化方式分别为__________和________。第一电离能介于B、N之间的第二周期元素有______种。
【答案】a 2 BN sp2 sp3 3
【解析】
(1)a. 随着核电荷数的增大,元素的原子半径逐渐减小,元素吸引电子的能力逐渐减弱,因此元素的电负性逐渐减小,正确;
b. F是现在已知元素中非金属性最强的元素,元素的原子可能获得电子形成阴离子;或者形成共用电子对,偏向F原子,因此没有与族序数相等的最高正化合价,而Cl、Br都有最高+7价,错误;
c. HF分子之间除了存在分子间作用力,还存在氢键,增加了分子之间的吸引力所以HF的沸点最高,另外两种元素的氢化物的沸点则是物质分子的相对分子质量越大,物质的熔沸点就越高,符合上述规律,错误;
d. 卤素单质是结构相似的物质,物质相对分子质量越大,分子间作用力就越大,物质的熔沸点就越高,错误。故选项是a。
(2)根据晶胞结构示意图可知,在一个晶胞中含有的B原子个数是:8×1/8+1=2;含有的N原子个数是:1+4×1/4=2,元素的非金属性N>B,因此该功能陶瓷的化学式为BN;
(3)BCl3中心原子B原子的杂化方式分别为sp2杂化;NCl3中心原子N原子杂化方式是sp3杂化。一般情况下同一周期的元素第一电离能随原子序数的增大而增大,但是第IIA、第VA元素的原子核外的价电子分别处于其轨道的全充满、半充满的稳定状态,第一电离能比原子序数大1号的相邻的元素还大,所以第一电离能介于B、N之间的第二周期元素有Be、C、O三种元素。