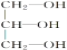题目内容
【题目】已知2SO2(g)+O2(g)![]() 2SO3(g)为放热反应,则下列说法正确的是
2SO3(g)为放热反应,则下列说法正确的是
A.单位时间内生成2molSO2,同时生成1molO2,说明反应达到平衡状态
B.上述热化学反应方程式说明反应物的总键能小于生成物的总键能
C.升高温度,正反应速率增大,逆反应速率减小
D.将2molSO2(g)和1molO2(g)置于一密闭容器中充分反应后生成2molSO3(g)
【答案】B
【解析】
A.单位时间内生成2molSO2,同时生成1molO2,反应方向相同,反应不一定达到平衡状态,A不正确;
B.上述热化学反应方程式的H<0,则H=反应物的总键能-生成物的总键能<0,说明反应物的总键能小于生成物的总键能,B正确;
C.升高温度,正反应速率增大,逆反应速率也增大,C不正确;
D.由于2SO2(g)+O2(g)![]() 2SO3(g)为可逆反应,所以将2molSO2(g)和1molO2(g)置于一密闭容器中充分反应后,生成SO3(g)的物质的量小于2mol,D不正确;
2SO3(g)为可逆反应,所以将2molSO2(g)和1molO2(g)置于一密闭容器中充分反应后,生成SO3(g)的物质的量小于2mol,D不正确;
故选B。

【题目】阿司匹林(乙酰水杨酸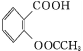 )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135 ℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备的主要反应为
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135 ℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备的主要反应为
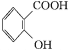 +(CH3CO)2O
+(CH3CO)2O![]()
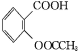 +CH3COOH
+CH3COOH
制备基本操作流程如下:
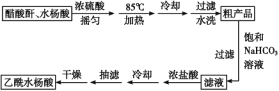
主要试剂和产品的物理常数:
名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
水杨酸 | 138 | 158(熔点) | 微溶 |
醋酸酐 | 102 | 139.4(沸点) | 反应 |
乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
请根据以上信息回答下列问题:
(1)合成过程中最合适的加热方法是__________。
(2)提纯粗产品时加入饱和NaHCO3溶液至没有CO2产生为止,再过滤,则加饱和NaHCO3溶液的目的是______
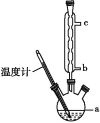
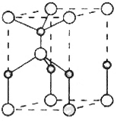
(3)另一种改进的提纯方法,称为重结晶提纯法。改进的提纯方法中加热回流的装置如图所示,仪器a的名称是____,冷凝管中冷凝水的进入口是____(填“b”或“c”),使用温度计的目的是_________
(4)检验产品中是否含有水杨酸的化学方法是_________
(5)该学习小组在实验中原料用量:2.76 g水杨酸、7.5 mL醋酸酐(ρ=1.08 g/cm3),最终称量产品m=2.92 g,则所得乙酰水杨酸的产率为____。