题目内容
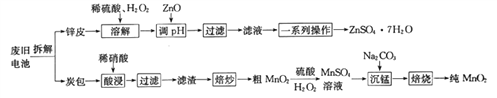
【题目】我国电池的年市场消费量约为80亿只,其中70%是锌锰干电池,利用废旧锌锰干电池制备硫酸锌晶体(ZnSO4·7H2O)和纯MnO2的工艺如下图所示:
已知:
①锌皮的主要成分为Zn,含有少量Fe;炭包的主要成分为ZnCl2、NH4Cl、MnO2、碳粉等,还含有少量的 Cu、Ag、Fe 等。
②Ksp[Zn(OH)2]=2.0×10-16;Ksp[Fe(OH)2]=8.0×10-16;Ksp[Fe(OH)3]=4.0×10-38。
(1)除去炭包中碳粉的操作为_____________。
A.酸浸 B.过滤 C.焙炒 D.焙烧
(2)粗MnO2转化为MnSO4时,主要反应的离子方程式为_____________________。
(3)焙烧时发生反应的化学方程式为_____________。
(4)制备硫酸锌晶体流程中,用ZnO调节溶液pH的目的是______________________________,若溶解时不加H2O2带来的后果是____________________。
(5)“草酸钠-高锰酸钾返滴法”可测定MnO2的纯度:取agMnO2样品于锥形瓶中,加入适量稀硫酸,再加入V1mLc1mol·L-1Na2C2O4溶液(足量),最后用c2mol·L-1的KMnO4溶液滴定剩余的Na2C2O4,达终点时消耗V2 mL标准KMnO4溶液。
①MnO2参与反应的离子方程式为_____________。
②该样品中MnO2的质量分数为__________________(假定杂质不参与反应,列出表达式即可)。
【答案】 C MnO2+H2O2+2H+=Mn2++O2↑+2H2O 2MnCO3+O2![]() 2MnO2+2CO2 除去溶液中的Fe3+杂质 Fe2+与Zn2+不能分离[或当Fe(OH)2沉淀完全时,Zn(OH)2也沉淀完全] MnO2+4H++C2O42-=Mn2++2CO2↑+2H2O
2MnO2+2CO2 除去溶液中的Fe3+杂质 Fe2+与Zn2+不能分离[或当Fe(OH)2沉淀完全时,Zn(OH)2也沉淀完全] MnO2+4H++C2O42-=Mn2++2CO2↑+2H2O ![]() ×100%
×100%
【解析】试题分析:本题通过对“利用废旧锌锰干电池制备硫酸锌晶体(ZnSO4·7H2O)和纯MnO2的工艺”探讨,主要考查除杂操作、反应方程式和离子方程式书写、沉淀的方法、中和滴定计算等基础知识,考查考生综合运用溶度积常数的能力、滴定实验的分析能力和对未知反应的判断书写能力。
解析:(1)炭包的主要成分为ZnCl2、NH4Cl、MnO2、碳粉等,还含有少量的 Cu、Ag、Fe 等,所以除去碳粉可以采用焙炒的方法,焙烧时,炭包内部的碳比较难与氧气反应除去,正确答案:C。(2)已知中粗MnO2在硫酸、H2O2作用下生成MnSO4,既MnO2+H2O2→MnSO4,反应过程中MnO2被还原,则H2O2被氧化生成O2,配平该反应为:MnO2+H2O2+2H+=Mn2++O2↑+2H2O。正确答案:MnO2+H2O2+2H+=Mn2++O2↑+2H2O。(3)上述生成的MnSO4加入Na2CO3后“沉锰”生成MnCO3沉淀,焙烧后生成MnO2,既MnCO3→MnO2,Mn元素被氧化,所以空气中O2作为氧化剂参加了该反应,配平该反应为:2MnCO3+O2![]() 2MnO2+2CO2。正确答案::2MnCO3+O2
2MnO2+2CO2。正确答案::2MnCO3+O2![]() 2MnO2+2CO2。(4)锌皮的主要成分为Zn,含有少量Fe,所以加入硫酸溶解并用H2O2氧化后,溶液中主要存在ZnSO4、Fe2(SO4)3、H2SO4,因此加入的ZnO与H2SO4反应使溶液酸性减弱,从而使Fe3+生成Fe(OH)3沉淀除去。已知Ksp[Zn(OH)2]=2.0×10-16;Ksp[Fe(OH)2]=8.0×10-16;Ksp[Fe(OH)3]=4.0×10-38,由于Zn(OH)2与Fe(OH)2的溶度积相差不大,所以沉淀Fe2+时Zn2+必然同时生成沉淀。若溶解时不加H2O2,溶液中主要存在ZnSO4、FeSO4、H2SO4,因此用ZnO反应过量H2SO4调节溶液pH使Fe2+沉淀时,Zn2+必然同时生成Zn(OH)2沉淀。正确答案:除去溶液中的Fe3+、Fe2+与Zn2+不能分离(或当Fe(OH)2沉淀完全时,Zn(OH)2也沉淀完全)。(5)纯度测定前半段,MnO2氧化Na2C2O4生成Mn2+和CO2,既MnO2+C2O42-→Mn2++CO2↑,配平该反应得MnO2+4H++C2O42-=Mn2++2CO2↑+2H2O。剩余的Na2C2O4被KMnO4氧化生成Mn2+和CO2,既MnO4-+C2O42-→Mn2++CO2↑,配平得2MnO4-+5C2O42-+16H+=2Mn2++5CO2↑+8H2O。则根据氧化还原反应电子守恒得
2MnO2+2CO2。(4)锌皮的主要成分为Zn,含有少量Fe,所以加入硫酸溶解并用H2O2氧化后,溶液中主要存在ZnSO4、Fe2(SO4)3、H2SO4,因此加入的ZnO与H2SO4反应使溶液酸性减弱,从而使Fe3+生成Fe(OH)3沉淀除去。已知Ksp[Zn(OH)2]=2.0×10-16;Ksp[Fe(OH)2]=8.0×10-16;Ksp[Fe(OH)3]=4.0×10-38,由于Zn(OH)2与Fe(OH)2的溶度积相差不大,所以沉淀Fe2+时Zn2+必然同时生成沉淀。若溶解时不加H2O2,溶液中主要存在ZnSO4、FeSO4、H2SO4,因此用ZnO反应过量H2SO4调节溶液pH使Fe2+沉淀时,Zn2+必然同时生成Zn(OH)2沉淀。正确答案:除去溶液中的Fe3+、Fe2+与Zn2+不能分离(或当Fe(OH)2沉淀完全时,Zn(OH)2也沉淀完全)。(5)纯度测定前半段,MnO2氧化Na2C2O4生成Mn2+和CO2,既MnO2+C2O42-→Mn2++CO2↑,配平该反应得MnO2+4H++C2O42-=Mn2++2CO2↑+2H2O。剩余的Na2C2O4被KMnO4氧化生成Mn2+和CO2,既MnO4-+C2O42-→Mn2++CO2↑,配平得2MnO4-+5C2O42-+16H+=2Mn2++5CO2↑+8H2O。则根据氧化还原反应电子守恒得![]() ,
,![]() ,MnO2质量分数为
,MnO2质量分数为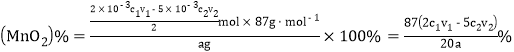 。正确答案:MnO2+4H++C2O42-=Mn2++2CO2↑+2H2O、
。正确答案:MnO2+4H++C2O42-=Mn2++2CO2↑+2H2O、![]() 。
。

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案【题目】已知:2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH=-25 kJ·mol-1。某温度下的平衡常数为400。此温度下,在1 L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如下表。下列说法中不正确的是( )
CH3OCH3(g)+H2O(g) ΔH=-25 kJ·mol-1。某温度下的平衡常数为400。此温度下,在1 L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如下表。下列说法中不正确的是( )
物质 | CH3OH | CH3OCH3 | H2O |
c/mol·L-1 | 0.08 | 1.6 | 1.6 |
A. 此时刻反应达到平衡状态
B. 容器内压强不变时,说明反应达平衡状态
C. 平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率不变
D. 平衡时,反应混合物的总能量降低40 kJ
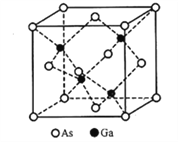
【题目】砷(As)可作为半导体村料锗(Ge)和硅的掺杂元素,这些材料广泛应用于发光二极管、红外线发射器等。回答下列问题:
(1)天然的SiO2存在形态有结晶形和无定形两大类,结晶形SiO2能自发的呈现规则多面体外形的性质被称为晶体的______________性,区分这两种形态的SiO2最可靠的方法足对固体进行___________实验。
(2)基态砷原子的价层电子排布图为_____________,最高能层符号为_____________,Ge、As、Se第一电离能从大到小的顺序为_____________________。
(3)锗元素与碳元素类似,可形成锗烷(GenH2n+2),但至今没有发现n大于5的锗烷,根据下表提供的数据分析其中的原因_____________________。
化学键 | C-C | C-H | Ge-Ge | Ge-H |
键能(kJ·mol-1) | 346 | 411 | 188 | 288 |
(4) GeCl4分子中的键角为_____________,GeH4分子中Ge的_____________轨道和H的_________轨道重叠形成σ键。
(5)立方砷化镓的晶胞如下图所示,已知晶胞边长为565pm,则Ga-As键的键长为___________pm(只列出算式即可),Ga-As键中共用电子对偏向____________(填“Ga”或“As”)。