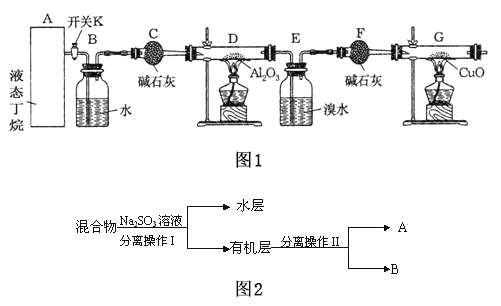
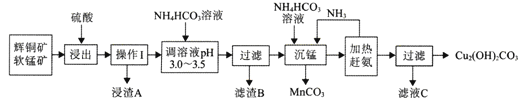
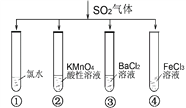
题目内容
【题目】
周期表前四周期元素R、X、Y、Z原子序效依次增大,RO2是红棕色气体:X位于元素周期表ⅣB族:同周期元素的基态原子中,Y的未成对电子最多;基态Z+最外层有18个电子。请回答下列问题:
(l)基态Y原子的价层电子轨道示意图为__________。
(2) RO3-的立体构型是______________,写出两个与RO3- 其有相同空间构型和键合形式的分子或离子____________。
(3) R及与R相邻的同周期元素中,第一电离能最大的是____(填元素符号), 原因是_____。
(4)若过渡金属离子具有未成对d电子,容易吸收可见光而发生d-d跃迁,因而它们的水合离子常常具有颜色;若过渡金属离子无未成对d电子,则其水合离子是无色的。下列水合离子为无色的是_____
A. X2+ B.X4+ C. Y3+ D. Z2+
(5)右图是Z与金的一种合金晶体的立方晶胞:
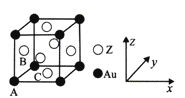
① 该晶体中,Z与Au的原子个数比为_________;
② 原子坐标参数可表示晶胞内各原子的相对位置。图示晶胞中,原子坐标参数A为(0, 0,0 );
B为(0,1/2,1/2)则C原子(底心)的坐标参数为__________。
③ 已知该立方晶胞的密度为dg/cm3 ,NA为阿伏伽德罗常数的值,则晶胞参数(描述晶胞的大小和形状)a=_______nm。(列出表达式即可)
【答案】 ![]() (2分) 平面三角形 CO32- SO3(或SeO3)(2分) N N原子3p轨道为半充满状态,相对稳定(2分) B(1分) 3:1 (1/2,1/2,0)
(2分) 平面三角形 CO32- SO3(或SeO3)(2分) N N原子3p轨道为半充满状态,相对稳定(2分) B(1分) 3:1 (1/2,1/2,0) ![]()
【解析】试题分析:由题给的条件可知, RO2是红棕色气体,R是N元素;基态Z+最外层有18个电子,Z是Cu元素;前四周期元素Y的未成对电子最多,Y价电子排布为3d54s1,Y是Cr元素;R、X、Y、Z原子序效依次增大,X位于元素周期表ⅣB族,X是Ti元素。
解析:(1)基态Cr原子的价电子排布为3d54s1,价层电子轨道示意图为![]() ; SO32-中S原子的孤电子对数=
; SO32-中S原子的孤电子对数=![]() 、价层电子对数=3+1=4,其空间构型为三角锥形,CO32- SO3与SO32-其有相同空间构型和键合形式;(3)同周期元素从左到右第一电离能逐渐增大,但N元素2p轨道为半充满状态,相对稳定,所以与N相邻的同周期元素C、N、O中,第一电离能最大的是N;(4)A.Ti2+ d 轨道有未成对电子,有颜色; B.X4+ d 轨道没有电子,所以没有颜色; C. Cr3+ d 轨道有未成对电子,有颜色; D. Cu2+ d 轨道有未成对电子,有颜色;(5)
、价层电子对数=3+1=4,其空间构型为三角锥形,CO32- SO3与SO32-其有相同空间构型和键合形式;(3)同周期元素从左到右第一电离能逐渐增大,但N元素2p轨道为半充满状态,相对稳定,所以与N相邻的同周期元素C、N、O中,第一电离能最大的是N;(4)A.Ti2+ d 轨道有未成对电子,有颜色; B.X4+ d 轨道没有电子,所以没有颜色; C. Cr3+ d 轨道有未成对电子,有颜色; D. Cu2+ d 轨道有未成对电子,有颜色;(5)
根据均摊原则,Z原子数6![]() =3,Au原子数
=3,Au原子数![]() =1,该晶体中,Z与Au的原子个数比为3:1;② 原子坐标参数可表示晶胞内各原子的相对位置。图示晶胞中,原子坐标参数A为(0, 0,0 );
=1,该晶体中,Z与Au的原子个数比为3:1;② 原子坐标参数可表示晶胞内各原子的相对位置。图示晶胞中,原子坐标参数A为(0, 0,0 );
B为(0,1/2,1/2),C原子(底心)的坐标参数为(1/2,1/2,0);③ 1 mol晶胞的质量为389g,1mol晶胞的体积为![]() ,则
,则![]() a=
a=![]() nm
nm