题目内容
【题目】某研究性学习小组设计实验探究元素周期律和化学反应速率。
(1)甲组同学欲用下图装置探究同周期和同主族元素非金属性的强弱。
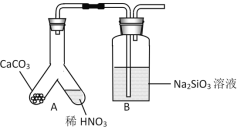
①A中反应现象为____,验证碳的非金属性比氮的___(填“强”或“弱”)。
②B中反应现象为____,验证碳的非金属性比硅的___(填“强”或“弱”)。
③结论:同一周期从左到右元素非金属性逐渐____(填“增强”或“减弱”); 同一主族从上到下元素非金属性逐渐_______(填“增强”或“减弱”)。
④某同学考虑到稀硝酸的挥发,在装置A和B之间增加一个盛有_______试剂的洗气瓶。
(2)乙组同学在恒容容器中进行了三个实验,反应为:2HI(g)H2(g)+I2(g),H2和I2的起始浓度均为0,反应物HI的浓度随反应时间的变化情况如下表:
实验序号 | 时间/min 浓度/molL-1 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 400 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
2 | 400 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
3 | 450 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
①实验1中,在10~20 min内,v(HI)=__________molL-1min-l。
②0~20 min内,实验2比实验1的反应速率______(填“快”或“慢”),其原因可能是_______________。
③实验3比实验2的反应达到平衡时间_________(填“长”或“短”),其原因是_________________________________________。
【答案】固体溶解,有气泡生成 弱 产生白色浑浊 强 增强 减弱 饱和碳酸氢钠溶液 0.01 慢 实验1中使用了催化剂 短 实验3的反应温度较高,化学反应速率较快,达到平衡时间短
【解析】
(1)①A中碳酸钙与稀硝酸反应生成二氧化碳、硝酸钙和水;
②A中生成的二氧化碳通入B中二氧化碳与硅酸钠反应生成硅酸沉淀;
③根据上述实验结论,结合元素周期律回答;
④某同学考虑到稀硝酸的挥发,影响实验现象和结论,需要将二氧化碳中混有的硝酸蒸汽除去;
(2)①结合表格数据,根据v=![]() 计算;
计算;
②实验2与实验1相比,初始浓度相同,体系温度相同,0~20 min内,实验2中HI的浓度的变化量小,据此分析;
③实验3比实验2相比,初始浓度相同,体系温度不同,实验2中达到平衡状态时间更长,据此分析;
(1)①A中碳酸钙与稀硝酸反应生成二氧化碳、硝酸钙和水,实验过程中A装置内固体溶解且有气泡生成,A装置中的反应过程符合强酸制弱酸原理,说明硝酸的酸性强于碳酸;最高价氧化物对应水化物的酸性越强,该元素非金属性越强,则证明碳的非金属性比氮的弱;
②A中生成的二氧化碳通入B中二氧化碳与硅酸钠反应生成硅酸沉淀,故B中的反应现象为产生白色浑浊,根据强酸制弱酸的原理,说明碳酸的酸性强于硅酸,根据①中的分析,则说明碳的非金属性比硅的强;
③根据上述实验结论,碳的非金属性比氮的弱,说明同一周期从左到右元素非金属性逐渐增强;碳的非金属性比硅的强,说明同一主族从上到下元素非金属性逐渐减弱;
④由于氮的非金属性强于硅,稀硝酸具有挥发性,挥发的硝酸进入B装置也可以使B中的硅酸钠溶液转化为硅酸,产生白色浑浊,影响实验现象和结论,需要将二氧化碳中混有的硝酸蒸汽除去。结合物质性质,二氧化碳与碳酸氢钠不反应,硝酸可与碳酸氢钠反应生成二氧化碳,因此在装置A和B之间增加一个盛有饱和碳酸氢钠的试剂洗气;
(2)①结合表格数据,实验1中,在10~20 min内, HI的浓度变化量为0.10 molL-1, v(HI)= ![]() =
=![]() =0.01 molL-1min-l;
=0.01 molL-1min-l;
②实验2与实验1相比,初始浓度相同,体系温度相同,0~20 min内,实验2中HI的浓度的变化量小,说明实验1的反应速率快,由于该反应是气体体积不变的体系,容器体积不变,压强对该平衡体系无影响,导致此变化的原因为实验1中加入催化剂,反应速率加快;
③结合表格数据,实验3比实验2相比,初始浓度相同,体系温度不同,实验2中达到平衡状态时间更长,说明实验3的反应速率快,原因为实验3的反应温度较高,化学反应速率较快,达到平衡时间短。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】氯气是一种重要的工业原料,液氯储存区贴有的说明卡如下:
包装 | 钢瓶 |
储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
泄漏处理 | NaOH、NaHSO3溶液吸收 |
下列解释事实的方程式不正确的是
A. 氯气用于自来水消毒:Cl2 + H2O![]() 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO-
B. 电解饱和食盐水制取Cl2:2Cl- +2H2O![]() 2OH-+ H2↑+Cl2↑
2OH-+ H2↑+Cl2↑
C. 浓氨水检验泄露的氯气,产生白烟:8NH3 + 3Cl2 === 6 NH4Cl + N2
D. 氯气“泄漏处理”中NaHSO3溶液的作用:HSO3-+ Cl2 + H2O === SO42-+ 3H+ + 2Cl-