题目内容
【题目】冬季我国北方大部分地区出现雾霾天气,引起雾霾的微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物、扬尘、重金属铜等。
(1)N元素原子核外电子云的形状有___种;基态铜原子的价电子排布式为___。
(2)N和O中第一电离能较小的元素是__;SO42-的空间构型___。
(3)雾霾中含有少量的水,组成水的氢元素和氧元素也能形成化合物H2O2,其中心原子的杂化轨道类型为___,H2O2难溶于CC14,其原因为___。
(4)PM2.5富含NO,NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中心离子的配位数为___。
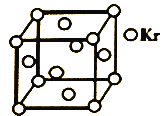
(5)测定大气中PM2.5浓度的方法之一是β-射线吸收法,β-射线放射源可用85Kr。已知Kr晶体的晶胞结构如图所示,设NA为阿伏加德罗常数的值,晶胞边长为540pm,则该晶体的密__g/cm3(只列式不计算,Kr摩尔质量为84g·mol-1)。
【答案】2 3d104s1 O 正四面体 sp3 H2O2为极性分子,CCl4为非极性溶剂,所以H2O2难溶于CCl4中 6 ![]()
【解析】
(1)N元素核外电子排布式为1s22s22p3,核外电子云形状有2种;Cu位于周期表中第4周期第ⅠB族,则其价电子排布式为3d104s1;
答案为2;3d104s1;
(2)N的2p为半满结构,较为稳定,第一电离能较大;对于SO42-,根据VSEPR理论,价层电子对数=4+![]() =4,则其空间构型为正四面体;
=4,则其空间构型为正四面体;
答案为O;正四面体;
(3)H2O2中O形成两根共价键,自身含有两对孤电子对,所以O为sp3杂化;H2O2分子中正负电荷中心不重合,为极性分子,CCl4为非极性分子,根据相似相容原理,极性分子难溶于非极性溶剂,所以H2O2难溶于CCl4;
答案为sp3;H2O2为极性分子,CCl4为非极性溶剂,所以H2O2难溶于CCl4中;
(4)NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中配体为NO和H2O,均为单齿配体,所以配位数为6;
答案为6;
(5)1个晶胞中含有Kr原子数目为8×![]() +6×
+6×![]() =4个,1mol晶胞的质量为m=4×85g,1mol晶胞体积为V=(540×10-10)3NAcm3,则晶体密度为ρ=
=4个,1mol晶胞的质量为m=4×85g,1mol晶胞体积为V=(540×10-10)3NAcm3,则晶体密度为ρ=![]() =
=![]() g/cm3;
g/cm3;
答案为![]() 。
。

【题目】氯化亚砜(SOCl2)常用于医药、农药、染料工业,也可在有机合成工业中作氯化剂。已知:SOCl2的相关性质如下表所示:
颜色、状态 | 熔点 | 沸点 | 腐蚀性 | 水解 |
无色或微黄液体 | -105℃ | 78℃ | 强 | 极易水解 |
现利用如图装置制备SOCl2。
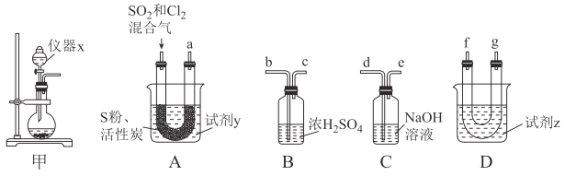
请回答下列问题:
Ⅰ.制备SO2和Cl2。
(1)本实验选用装置甲制备SO2和Cl2,装置甲中仪器x的名称为___;若以KMnO4和浓盐酸反应制备Cl2,反应的离子方程式为___。
Ⅱ.制备SOCl2。
以活性炭作为催化剂,SO2和C12可以和S粉在180~200℃时反应合成SOCl2,选用装置A、B、C、D进行制备(夹持、加热装置略去)。
(2)按气流从左到右的方向,装置A、B、C、D的连接顺序为___(填仪器接口的字母编号)。
(3)试剂y为___(填选项字母,下同);试剂z为___。
A.热水 B.乙醇 C.石蜡油 D.冰水
(4)装置A中U形管内发生反应的化学方程式为___。
(5)装置C的作用为___;若装置A处通入的SO2和Cl2的物质的量之比为1:3,则装置C中生成的盐为___(填化学式);请设计实验验证装置C中生成的盐中含有SO42-:____。
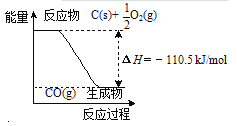
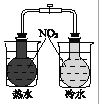
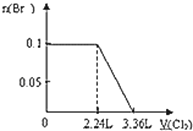
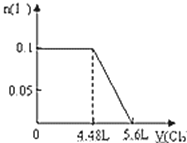
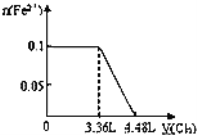
【题目】下列图示与文字叙述相符合的是
A | B |
|
|
12 g C(s)与一定量O2(g)反应生成14 g CO(g),放出的热量为110.5 kJ | 热水浴的烧瓶中气体颜色较浅 |
C | D |
|
|
验证AgCl溶解度大于Ag2S | 钢闸门作为阴极而受到保护 |
A. AB. BC. CD. D