题目内容
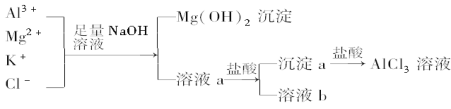
【题目】下图为相关物质间的转化关系,其中甲、丙为生活中常见的金属单质,乙、丁为非金属单质且丁为气态,E为白色沉淀,D为浅绿色溶液。请回答:

(1)组成甲的元素在元素周期表中的位置为____________,请列举乙单质的一种用途__________,用电子式表示丁的形成过程________________________
(2)在C溶液中滴入2滴酚酞,再逐滴加入稀盐酸至红色消失,可得到一种胶体,该胶体的胶粒成分是________________(化学式)
(3)反应①的离子方程式为____________________________
(4)将B的稀溶液加水稀释,在图中画出溶液的pH随加水体积的变化趋势曲线。__________

(5)将等物质的量的A和NaOH混合溶于水,该溶液中离子的物质的量浓度由大到小的顺序为:________________________
(6)若反应②中盐酸过量,向D溶液中滴加84消毒液,溶液的颜色发生了变化,该反应的离子方程式为________________________________________,小辉同学欲设计实验,验证D溶液中的阳离子尚未完全被氧化,请你将实验过程补充完整:取反应液少许于试管中,滴加______________________,则证明D中的阳离子未完全被氧化。
【答案】第三周期第IIIA族 光电池或半导体材料 H· + ·H → H︰H H2SiO3 Al3+ + 3AlO2-+ 6H2O═4Al(OH)3↓ 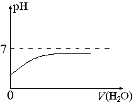 c(Na+)>c(OH-)>c(AlO2-)>c(H+) ClO-+ 2Fe2++ 2H+===Cl-+ 2Fe3++ H2O 滴加铁氰化钾{ K3[Fe(CN)6] }溶液,若生成蓝色沉淀
c(Na+)>c(OH-)>c(AlO2-)>c(H+) ClO-+ 2Fe2++ 2H+===Cl-+ 2Fe3++ H2O 滴加铁氰化钾{ K3[Fe(CN)6] }溶液,若生成蓝色沉淀
【解析】
应用元素化合物知识,结合题中文字信息,推断框图中各物质,进而回答相关问题。
生活中常见金属单质有铝、铁、铜,图中甲能与稀盐酸、NaOH溶液反应生成气体非金属单质丁,则甲为Al,丁为H2,A为NaAlO2溶液,B为AlCl3溶液,进而白色沉淀E为Al(OH)3。因D为浅绿色溶液,则丙为Fe,D为FeCl2溶液。非金属单质乙能与NaOH溶液反应生成H2,则乙为Si,C为Na2SiO3溶液。
(1)甲(Al)原子核外有3个电子层,最外层有3个电子,在元素周期表中位于第三周期第IIIA族。乙单质(Si)是常用的半导体材料,用于光电池、计算机芯片。电子式表示丁(H2)的形成过程为H· + ·H → H︰H。
(2)在Na2SiO3溶液中滴入稀盐酸得到硅酸胶体,胶粒成分是H2SiO3。
(3)反应①为双水解反应,其离子方程式为Al3+ + 3AlO2-+ 6H2O═4Al(OH)3↓。
(4)AlCl3溶液中存在水解平衡Al3+ + 3H2O![]() Al(OH)3+ 3H+,加水稀释时平衡右移,n(H+)增大,c(H+)减小,pH增大,但始终小于7。
Al(OH)3+ 3H+,加水稀释时平衡右移,n(H+)增大,c(H+)减小,pH增大,但始终小于7。
(5)等物质的量NaAlO2和NaOH的混合溶液中,溶质完全电离,c(Na+)最大;AlO2-水解AlO2-+ 2H2O![]() Al(OH)3+OH-,使c(OH-)>c(AlO2-);考虑水电离,c(H+)最小。故溶液中离子的物质的量浓度由大到小的顺序c(Na+)>c(OH-)>c(AlO2-)>c(H+)。
Al(OH)3+OH-,使c(OH-)>c(AlO2-);考虑水电离,c(H+)最小。故溶液中离子的物质的量浓度由大到小的顺序c(Na+)>c(OH-)>c(AlO2-)>c(H+)。
(6)反应②中盐酸过量,则D溶液中溶质为FeCl2和HCl,滴加84消毒液(NaClO)后发生氧化还原反应,该反应的离子方程式为ClO-+ 2Fe2++ 2H+==Cl-+ 2Fe3++ H2O。证明Fe2+未完全被氧化,即检验Fe2+,可滴加铁氰化钾{ K3[Fe(CN)6] }溶液,生成蓝色沉淀。

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案