题目内容
19.将等物质的量的乙烷和溴蒸气混合后,在光照条件下充分反应,所得产物中物质的量最大的是( )| A. | CH3CH2Br | B. | CHBr2CHBr2 | C. | CBr3CBr3 | D. | HBr |
分析 将等物质的量的乙烷和溴蒸气混合后,在光照条件下充分反应,乙烷和溴发生取代反应生成溴代烃和HCl,每一步中都生成HBr,据此分析解答.
解答 解:将等物质的量的乙烷和溴蒸气混合后,在光照条件下充分反应,乙烷和溴发生取代反应生成溴代烃和HCl,无论反应生成哪种溴代烷,但每一步中都生成HBr,且生成溴代烷和HBr的个数之比为1:1,所以产物中物质的量最大的是HBr,故选D.
点评 本题考查化学方程式有关计算,为高频考点,明确方程式中各个物理量之间关系是解本题关键,注意:烷烃和溴的取代反应中被取代H原子与溴分子个数之比为1:1,为易错点.

练习册系列答案
相关题目
9.某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色.
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含Br2(填化学式,下同)所致.
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含Fe3+所致.
(3)设计实验并验证:丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的.
供选用的试剂:a.酚酞试液 b.四氯化碳 c.无水酒精 d.硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象.(试剂填序号)
(4)应用与拓展:
①在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为2Fe2++Br2=2Fe3++2Br-.
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有$\frac{1}{3}$的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为1.2mol/L.
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含Br2(填化学式,下同)所致.
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含Fe3+所致.
(3)设计实验并验证:丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的.
供选用的试剂:a.酚酞试液 b.四氯化碳 c.无水酒精 d.硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象.(试剂填序号)
| 选用试剂 | 实验现象 | |
| 方案1 | ||
| 方案2 |
①在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为2Fe2++Br2=2Fe3++2Br-.
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有$\frac{1}{3}$的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为1.2mol/L.
10.下列反应中,反应后固体物质的质量减少的是( )
| A. | 二氧化碳通过Na202粉末 | |
| B. | 向H202的溶液中加入一定量Mn02 | |
| C. | Cu2S在足量的02中灼烧 | |
| D. | 将铜投入稀盐酸酸化的KN03溶液并加热 |
7.下列物质混合后,能发生离子反应的是( )
| A. | 硝酸钠溶液和氯化钡溶液 | B. | 硝酸钠溶液与氯化钾溶液 | ||
| C. | 稀盐酸和碳酸钠溶液 | D. | 稀硫酸滴到铜片上 |
8.由铜、锌、CuSO4溶液,ZnSO4溶液组成如图所示的原电池,则下列说法正确是( )


| A. | a极为铜,b极为锌 | |
| B. | 当正极质量增加64g时,负极质量减小65g | |
| C. | A池中盛放的是CuSO4溶液,B池中盛放的是ZnSO4溶液 | |
| D. | 盐桥中的阳离子向锌极移动,阴离子向铜极移动 |
9.用惰性电极实现如下电解过程,下列说法正确的是( )
| A. | 电解稀硫酸溶液实质上是电解水,故溶液pH不变 | |
| B. | 电解稀氢氧化钠溶液要消耗OH-,故溶液pH减小 | |
| C. | 电解硫酸钠溶液,在阴极上发生反应:4OH-4e-═2H2O+O2↑ | |
| D. | 电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:1 |
 -CH=CHCOOCH2CH2-
-CH=CHCOOCH2CH2-
 CH=CH2+2ROH+2CO+O2CH3
CH=CH2+2ROH+2CO+O2CH3  CH=CHCOOR+2H2O
CH=CHCOOR+2H2O 或
或 (写1种);由Ⅳ生成Ⅱ的反应条件为NaOH醇溶液,加热.
(写1种);由Ⅳ生成Ⅱ的反应条件为NaOH醇溶液,加热.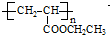 可用于制备涂料,其单体结构简式为CH2=CHCOOCH2CH3.
可用于制备涂料,其单体结构简式为CH2=CHCOOCH2CH3.