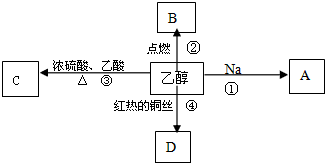
题目内容
19.对于Zn(s)+H2SO4(aq)═ZnSO4(aq)+H2(g)△H<0 的化学反应,下列叙述错误的是( )| A. | 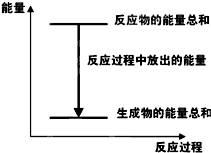 反应过程中能量关系可用如图表示 | |
| B. | 若将该反应设计成原电池则锌为负极 | |
| C. | △H的值与反应方程式的化学计量数有关 | |
| D. | 若将其设计为原电池,当有32.5g锌溶解时,转移电子数为2NA |
分析 对于Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g)△H<0,反应为放热反应,则反应物的总能量大于生成物的总能量,当将该反应设计呈原电池时,Zn为负极,被氧化,正极上析出氢气,以此解答该题.
解答 解:A.反应为放热反应,则反应物的总能量大于生成物的总能量,图示正确,故A正确;
B.反应中Zn被氧化生成ZnSO4,当将该反应设计呈原电池时,Zn为负极,故B正确;
C.热化学方程式中,反应热与物质的物质的量呈正比,故C正确;
D.若将其设计为原电池,当有32.5g锌溶解时,转移电子1mol,故D错误.
故选D.
点评 本题考查化学反应能量的变化,题目难度不大,本题注意反应热以及原电池的工作原理,学习中注意相关知识的理解和掌握.

练习册系列答案
相关题目
9.能证明乙醇分子中有一个羟基的事实是( )
| A. | 乙醇完全燃烧生成CO2和H2O | |
| B. | 0.1mol乙醇与足量钠反应生成0.05molH2 | |
| C. | 乙醇能与水以任意比互溶 | |
| D. | 乙醇能发生氧化反应 |
10.下列变化中,需要加入氧化剂才能实现的是( )
| A. | KCl→AgCl | B. | Cl2→NaClO | C. | SiO2→Si | D. | Cu→CuSO4 |
7.实验室中需要配制2mol•L-1的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是( )
| A. | 950mL,111.2g | B. | 1000 mL,117.0g | C. | 500mL,117g | D. | 任意规格,111.2g |
11.下列关于电解质溶液中离子关系的说法或离子方程式书写正确的是( )
| A. | 用铜作电极电解NaCl溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | 常温下,向醋酸钠溶液中滴加少量醋酸使溶液的pH=7,则混合溶液中:c(Na+)=c(CH3COO-) | |
| C. | 磷酸一氢钠溶液水解:HPO42-+H2O?PO42-+H3O+ | |
| D. | 常温下,由水电离产生的c(H+)=10-12mol•L-1的溶液,NH4+、SO42-、HCO3-、Cl-能大量共存 |
8.下列叙述正确的是( )
| A. | 钾的原子质量就是钾的相对原子质量 | |
| B. | 一个硫原子的实际质量约等于$\frac{32}{(6.02×1{0}^{23})}$g | |
| C. | 水的相对分子质量为18g | |
| D. | 17g OH-中所含电子数为9NA |
 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的NaOH溶液、足量的CuSO4溶液、足量的Na2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得乙中c电极质量增加.据此回答下列问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的NaOH溶液、足量的CuSO4溶液、足量的Na2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得乙中c电极质量增加.据此回答下列问题: