题目内容
1.下列各物质所含原子个数按由大到小的顺序排列的是①>④>③>②.①0.5m NH3
②1mol He
③0.5mol H2O
④0.2mol H3PO4.
分析 根据N=nNA,结合每个分子含有的原子数目计算含有原子总物质的量,注意稀有气体为单原子分子,据此解答.
解答 解:①0.5mol NH3所含原子的物质的量为:0.5mol×4=2mol;
②1mol He所含原子的物质的量为:1mol×1=1mol;
③0.5mol H2O所含原子的物质的量为:0.5mol×3=1.5mol;
④0.2mol H3PO4所含原子的物质的量为:0.2mol×8=1.6mol;所以原子个数按由大到小的顺序为:①>④>③>②,故答案为:①>④>③>②
点评 本题考查物质的量有关计算、微粒数目计算,比较基础,注意理解化学式的意义.

练习册系列答案
相关题目
12.下列反应的离子方程式书写正确的是.( )
| A. | 向Ba(OH)2溶液中加入NaHSO4溶液至刚好沉淀完全:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | Cu与浓H2SO4 共热:Cu+4H++SO42-$\frac{{\underline{△}}}{\;}$ZCu2++SO2↑+2H2O | |
| C. | 向FeSO4溶液中滴加H2O2溶液:Fe2++H2O2+2H+═Fe3++2H2O | |
| D. | 将SO2通入Ca(ClO)2溶液:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO |
9.甲烷与氯气发生反应,按照课本的实验,用集气瓶收集一定比例的甲烷与氯气,然后倒扣在盛有饱和食盐水的水槽中,用强光照射,该实验不可能出现的现象是( )
| A. | 集气瓶内液面上升 | B. | 集气瓶内气体颜色变浅 | ||
| C. | 水槽里溶液仍保持澄清 | D. | 集气瓶壁附有油状液体 |
16.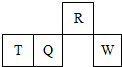 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断错误的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断错误的是( )
 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断错误的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断错误的是( )| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 原子半径:T>Q>R | |
| D. | T的最高价氧化物的水化物能与氨水反应 |
6.下列说法不正确的是( )
| A. | 硫酸的摩尔质量(g/mo1)与6.02×1023个磷酸分子的质量(g)在数值上相等 | |
| B. | 6.02×1023个N2和6.02×1023个O2的质量比等于7:8 | |
| C. | 3.2gO2所含的原子数目约为0.2×6.02×1023个 | |
| D. | 常温、常压下,0.5×6.02×1023个二氧化碳分子的质量是44g |
11.在标准状况下750mL含O3的氧气,其中若O3完全分解,其体积为780mL.如果将此含有的O3的氧气1L,通入适量的KI溶液中,发生如下反应,2KI+O3+H2O=2KOH+I2+O2,则析出I2的质量为( )
| A. | 0.68g | B. | 0.81g | C. | 0.91g | D. | 1.21g |

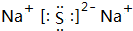 ,属于离子晶体
,属于离子晶体