题目内容
【题目】取5.48gNa2CO3和NaHCO3的混合物溶于水配成200mL溶液,将溶液分成两等份。
(1)往其中一份溶液中加入300mLBa(OH)2溶液时,恰好使生成白色沉淀的量最多,测得反应后溶液的c(OH-)=0.100mol/L(混合溶液体积改变忽略不计)。
①发生反应的离子方程式为_______________。
②n(Na2CO3)=______mol;n(NaHCO3)=______mol。
(2)往另一份溶液中缓慢滴加0.100mol/L盐酸,请将产生二氧化碳气体的体积(标准状况下且不考虑CO2在水中的溶解)随滴加盐酸的体积变化的曲线绘制在坐标系中。______

【答案】 HCO3-+OH-+Ba2+=BaCO3↓+H2O、Ba2++CO32-=BaCO3↓ 0.01 0.02 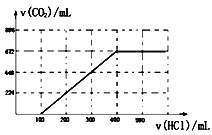
【解析】(1)①碳酸钠、碳酸氢钠均与氢氧化钡反应,生成白色沉淀的量最多,这说明碳元素全部转化为碳酸钡,所以发生反应的离子方程式为HCO3-+OH-+Ba2+=BaCO3↓+H2O、Ba2++CO32-=BaCO3↓。②设每一份中碳酸钠和碳酸氢钠的物质的量分别是xmol、ymol,则106x+84y=2.74,反应的溶液是氢氧化钠,根据钠离子守恒可知2x+y=0.03,解得x=0.01,y=0.02。(2)往另一份溶液中缓慢滴加0.100mol/L盐酸,碳酸钠首先反应转化为碳酸氢钠,0.01mol碳酸钠消耗盐酸是100mL,反应后溶液中碳酸氢钠共计是0.03mol,完全反应生成二氧化碳需要盐酸是300mL,生成二氧化碳是0.03mol,在标准状况下的体积是672mL,因此产生二氧化碳气体的体积(标准状况下且不考虑CO2在水中的溶解)随滴加盐酸的体积变化的曲线为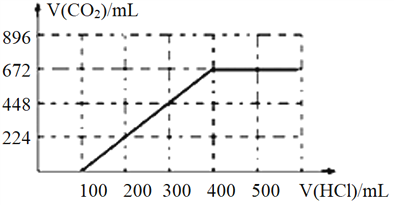 。
。

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目