��Ŀ����
����Ŀ����4mol A�����2mol B������2L���ܱ������л�ϣ�����һ�������·������·�Ӧ��2A��g��+B��g��2C��g������Ӧ2s����C��Ũ��Ϊ0.6mol/L������˵����ȷ���ǣ� ��
A.������A��ʾ2 s�ڵ�ƽ����Ӧ����Ϊ0.3 mol/��Ls��
B.������B��ʾ2 s�ڵ�ƽ����Ӧ����Ϊ0.6 mol/��Ls��
C.2 s������A��ת����Ϊ70%
D.2 s������B��Ũ��Ϊ0.35 mol/L
���𰸡�A
���������⣺��Ӧ2s����C��Ũ��Ϊ0.6mol/L�����ʵ���=0.6mol/L��2L=1.2mol��
2A��g�� | + | B��g�� | 2C��g�� | ||
��ʼ����mol�� | 4 | 2 | 0 | ||
�仯����mol�� | 1.2 | 0.6 | 1.2 | ||
2sĩ����mol�� | 2.8 | 1.4 | 1.2 |
A��������A��ʾ2 s�ڵ�ƽ����Ӧ����= ![]() =0.3 mol/��Ls������A��ȷ��
=0.3 mol/��Ls������A��ȷ��
B��������B��ʾ2 s�ڵ�ƽ����Ӧ����= ![]() =0.15 mol/��Ls����B����
=0.15 mol/��Ls����B����
C��2 s������A��ת����= ![]() ��100%=30%����C����
��100%=30%����C����
D��2 s������B��Ũ��= ![]() =0.7mol/L����D����
=0.7mol/L����D����
��ѡA��

����Ŀ��Bodensteins�о������з�Ӧ��2HI(g)![]() H2(g)+I2(g) H=+11 kJ��mol-1����716Kʱ�����������е⻯������ʵ�������x(HI)�뷴Ӧʱ��t�Ĺ�ϵ���±���
H2(g)+I2(g) H=+11 kJ��mol-1����716Kʱ�����������е⻯������ʵ�������x(HI)�뷴Ӧʱ��t�Ĺ�ϵ���±���
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI�� | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
������ʵ�����ݼ���õ�v����x(HI)��v����x(H2)�Ĺ�ϵ������ͼ��ʾ�����ı��������ٴδﵽƽ��ʱ�������й���������ȷ����
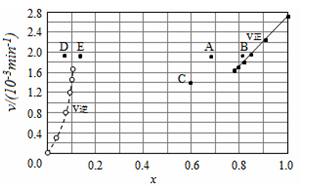
A���������¶ȵ�ijһ�¶ȣ��ٴδﵽƽ��ʱ����Ӧ����ֱܷ���A��E
B�����ٴγ���a mol HI����ﵽƽ��ʱ����Ӧ��ĺ�����ֵ���䣬������ֵ����
C�����ı������������ѹǿ���ٴδﵽƽ��ʱ����Ӧ����ı�����ǰ��ͬ
D�����ı��������ʹ�ô������ٴδﵽƽ��ʱ����Ӧ����ı�����ǰ��ͬ

