题目内容
各可逆反应达平衡后,改变反应条件,其变化趋势正确的是
CD
解析试题分析:A选项反应实质是铁离子与硫氰跟离子反应生成硫氰化铁,因此增加氯化钾的量,对平衡是无影响的。所以A选项是错误的。B选项该反应是放热反应,因此增大温度,反应向吸热的方向进行,即逆反应方向进行,逆反应速率增大的速率大于正反应速率增大的速率。但是B点不在该曲线上,因此B选项是错误的。C选项,平衡常数只与温度有关,降低温度,平衡常数也会减小,因此C选项是正确的.D选项该反应属于放热反应,增大温度,反应向逆反应方向进行,因此温度越高,在平衡时AB3的百分含量越低,因此D选项是正确的。
考点:考查影响化学平衡因素的相关知识点

练习册系列答案
相关题目
恒温恒容的容器内,不可作为可逆反应I2(g)+H2(g) 2HI(g)达到平衡状态的标志的是
2HI(g)达到平衡状态的标志的是
| A.1 mol H—H键断裂,同时有2 mol H—I键断裂 | B.容器内气体的总压强不再变化 |
| C.H2的物质的量浓度不再变化 | D.混合气体的颜色不再变化 |
80℃时,2L密闭容器中充入0.40molN2O4,发生反应
N2O4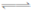 2NO2
2NO2 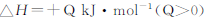 ,获得如下数据:
,获得如下数据: 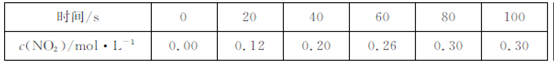 下列判断正确的是
下列判断正确的是
| A.升高温度该反应的平衡常数K减小 |
B.20~40s内,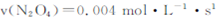 |
| C.反应达平衡时,吸收的热量为0.30QkJ |
| D.100s时再通入0.40molN2O4,达新平衡时N2O4的转化率增大 |
已知:N2(g)+3H2(g) 2NH3(g);△H="-92.4" kJ/mol,下列结论正确的是
2NH3(g);△H="-92.4" kJ/mol,下列结论正确的是
| A.在密闭容器中加入1 molN2(g)和3 molH2(g)充分反应放热92.4 kJ |
B.N2(g)+3H2(g) 2NH3(l);△H="-Q" kJ/mol,则Q>92.4 2NH3(l);△H="-Q" kJ/mol,则Q>92.4 |
| C.增大压强,平衡向右移动,平衡常数增大 |
| D.若一定条件下反应达到平衡,N2的转化率为20%,则H2的转化率一定为60% |
体积恒定的密闭容器中,反应2SO2(g)+O2(g) 2SO3(g) △H <0达平衡后,采用下列措施一段时间后,既能增大逆反应速率又能使平衡向正方向移动的是
2SO3(g) △H <0达平衡后,采用下列措施一段时间后,既能增大逆反应速率又能使平衡向正方向移动的是
| A.通入大量O2 | B.增大容器容积 | C.移去部分SO3 | D.降低体系温度 |
 SO3(g) +NO(g),
SO3(g) +NO(g),
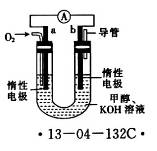
 A2(g)+B2(g)达到平衡状态的标志是
A2(g)+B2(g)达到平衡状态的标志是