题目内容
【题目】常温下,下列有关溶液中微粒的物质的量浓度关系正确的是( )
A.c(![]() )相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)>c[(NH4)2SO4]>c(NH4Cl)
)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)>c[(NH4)2SO4]>c(NH4Cl)
B.将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体后的溶液中:c(H+)+c(H2CO3)=c(OH-)+c(![]() )+c(NH3·H2O)
)+c(NH3·H2O)
C.溶液X:10 mL 0.1 mol·L-1 NaCl;溶液Y:10 mL 0.1 mol·L-1 CH3COONa,则:X中离子总浓度>Y中离子总浓度
D.少量的氯气通入过量冷的0.1 mol·L-1NaOH溶液中:c(Na+)=c(HClO)+c(ClO-)+c(Cl-)
【答案】BC
【解析】
A.(NH4)2SO4可以电离出两个铵根,所以c(![]() )相等时,其浓度最小,NH4HSO4可以电离出氢离子抑制铵根的水解,所c(NH4HSO4)< c(NH4Cl),则三种溶液的浓度大小关系为:c(NH4Cl)> c(NH4HSO4)> c[(NH4)2SO4],故A错误;
)相等时,其浓度最小,NH4HSO4可以电离出氢离子抑制铵根的水解,所c(NH4HSO4)< c(NH4Cl),则三种溶液的浓度大小关系为:c(NH4Cl)> c(NH4HSO4)> c[(NH4)2SO4],故A错误;
B.析出部分NaHCO3晶体后,可以认为溶液中溶质为NH4Cl和NaHCO3,溶液中存在电荷守恒:c(Na+)+c(H+)+c(![]() )=c(OH-)+c(HCO
)=c(OH-)+c(HCO![]() )+2c(
)+2c(![]() )+c(Cl-),溶液中存在物料守恒:c(Na+)=c(HCO
)+c(Cl-),溶液中存在物料守恒:c(Na+)=c(HCO![]() )+c(
)+c(![]() )+c(H2CO3),c(Cl-)=c(NH4+)+c(NH3H2O),联立可得c(H+)+c(H2CO3)=c(OH-)+c(
)+c(H2CO3),c(Cl-)=c(NH4+)+c(NH3H2O),联立可得c(H+)+c(H2CO3)=c(OH-)+c(![]() )+c(NH3H2O),故B正确;
)+c(NH3H2O),故B正确;
C.NaCl溶液中存在电荷守恒c(Na+)+c(H+)= c(OH-)+ c(Cl-),所以溶液中离子总浓度即为2[c(Na+)+c(H+)],同理可得醋酸钠溶液中离子总浓度也为2[c(Na+)+c(H+)],两溶液中c(Na+)相同,但醋酸钠溶液中存在醋酸根的水解使溶液显碱性,所以氢离子浓度较小,则X中离子总浓度>Y中离子总浓度,故C正确;
D.少量的氯气通入过量冷的0.1 mol·L-1NaOH溶液中,溶液中的溶质为NaCl、NaClO、NaOH,所以c(Na+)>c(HClO)+c(ClO-)+c(Cl-),故D错误;
故答案为BC。

【题目】新型电池在飞速发展的信息技术中发挥着越来越重要的作用。Li2FeSiO4是极具发展潜力的新型锂离子电池电极材料,在苹果的几款最新型的产品中已经有了一定程度的应用。其中一种制备Li2FeSiO4的方法为:固相法:2Li2SiO3+FeSO4![]() Li2FeSiO4+Li2SO4+SiO2
Li2FeSiO4+Li2SO4+SiO2
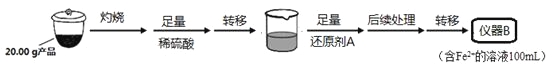
某学习小组按如下实验流程制备Li2FeSiO4并测定所得产品中Li2FeSiO4的含量。
实验(一)制备流程:
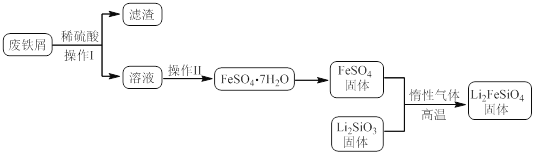
实验(二) Li2FeSiO4含量测定:
从仪器B中取20.00 mL溶液至锥形瓶中,另取0.2000 mol·Lˉ1的酸性KMnO4标准溶液装入仪器C中,用氧化还原滴定法测定Fe2+含量。相关反应为:MnO4- +5Fe2++8H+=Mn2++5Fe3++4H2O,杂质不与酸性KMnO4标准溶液反应。经4次滴定,每次消耗KMnO4溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积 | 20.00 mL | 19.98mL | 21.38mL | 20.02mL |
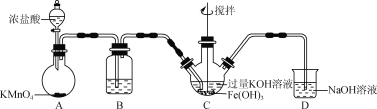
(1)实验(二)中的仪器名称:仪器B ,仪器C 。
(2)制备Li2FeSiO4时必须在惰性气体氛围中进行,其原因是 。
(3)操作Ⅱ的步骤 ,在操作Ⅰ时,所需用到的玻璃仪器中,除了普通漏斗、烧杯外,还需 。
(4)还原剂A可用SO2,写出该反应的离子方程式 ,此时后续处理的主要目的是 。
(5)滴定终点时现象为 ;根据滴定结果,可确定产品中Li2FeSiO4的质量分数为 ;若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的Li2FeSiO4含量 。(填“偏高”、“偏低”或“不变”)。