题目内容
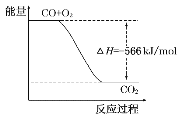
【题目】高铁酸钾(K2FeO4)为高效净水剂,紫色固体,易溶于水,微溶于KOH溶液;具有强氧化性,在酸性溶液中完全、快速产生O2,在碱性溶液中较稳定。某实验小组制备高铁酸钾并探究其性质。
(1)制备K2FeO4(夹持装置略)
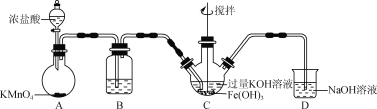
①装置B中所用试剂为____。
②C中得到紫色固体和溶液,C中发生的主要反应为________(用化学方程式表示)。
(2) 探究K2FeO4的性质
①将K2FeO4溶液滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明酸性条件下![]() 与
与![]() 氧化性的强弱关系,请说明理由:____。
氧化性的强弱关系,请说明理由:____。
②取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,某同学设计了以下方案:取少量a,滴加KSCN溶液至过量,溶液呈红色。该方案并不完善,因为溶液变红的原因可能是____,___(用离子方程式表示),重新设计实验方案,证明是K2FeO4氧化了Cl-而产生Cl2:将装置C中混合物过滤,___。[实验中必须使用的试剂:盐酸、KOH溶液、淀粉碘化钾试纸]
【答案】饱和食盐水 3Cl2+2Fe(OH)3+10KOH===2K2FeO4+6KCl+8H2O 能,![]() 在过量酸的作用下完全转化为Fe3+和O2,溶液浅紫色一定是
在过量酸的作用下完全转化为Fe3+和O2,溶液浅紫色一定是![]() 的颜色
的颜色
(或不能,补充对比实验,向K2FeO4紫色溶液中滴加过量稀H2SO4,观察溶液紫色快速褪去还是显浅紫色) ![]() +20H+===4Fe3++3O2↑+10H2O Fe3++3SCN-===Fe(SCN)3 将所得固体用KOH溶液充分洗涤,再用KOH溶液将少量固体溶解,得到紫色溶液,向溶液中滴加盐酸,产生黄绿色气体,使湿润的淀粉KI试纸变蓝
+20H+===4Fe3++3O2↑+10H2O Fe3++3SCN-===Fe(SCN)3 将所得固体用KOH溶液充分洗涤,再用KOH溶液将少量固体溶解,得到紫色溶液,向溶液中滴加盐酸,产生黄绿色气体,使湿润的淀粉KI试纸变蓝
【解析】
①由实验装置可知,A中发生2MnO4-+10Cl-+16H+═5Cl2↑+2Mn2++8H2O,B中饱和食盐水可除去氯气中的HCl;②C中在碱性条件下Cl2可以氧化Fe(OH)3制取K2FeO4,反应为3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O;
(1)①装置A是制备Cl2,装置B为净化装置,用于除去Cl2中的HCl,装置B中所用试剂为饱和食盐水;
②在碱性条件下Cl2可以氧化Fe(OH)3制取K2FeO4,反应方程式为
3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O;
(2)①K2FeO4在酸性溶液中具有强氧化性,能将Mn2+氧化成![]() ,溶液呈浅紫色证明含有
,溶液呈浅紫色证明含有![]() ,故理由是:能,
,故理由是:能,![]() 在过量酸的作用下完全转化为Fe3+和O2,溶液浅紫色一定是
在过量酸的作用下完全转化为Fe3+和O2,溶液浅紫色一定是![]() 的颜色(或不能,补充对比实验,向K2FeO4紫色溶液中滴加过量稀H2SO4,观察溶液紫色快速褪去还是显浅紫色);
的颜色(或不能,补充对比实验,向K2FeO4紫色溶液中滴加过量稀H2SO4,观察溶液紫色快速褪去还是显浅紫色);
②K2FeO4具有强氧化性,在酸性溶液中快速产生O2,滴加KSCN溶液至过量,溶液呈红色是由于Fe3+与SCN-结合成血红色的配合物,用离子方程式表示原因为:![]() +20H+===4Fe3++3O2↑+10H2O,Fe3++3SCN-===Fe(SCN)3;
+20H+===4Fe3++3O2↑+10H2O,Fe3++3SCN-===Fe(SCN)3;
为了证明是K2FeO4氧化了Cl-而产生Cl2:将装置C中混合物过滤,将所得固体用KOH溶液充分洗涤,再用KOH溶液将少量固体溶解,得到紫色溶液,向溶液中滴加盐酸,产生黄绿色气体,由于氯气能够把碘离子氧化为碘单质,所以氯气使湿润的淀粉KI试纸变蓝。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案