题目内容
9.下列有关氯气的叙述中,正确的是( )| A. | 工业上常用MnO2和浓盐酸共热来制取氯气 | |
| B. | 新制氯水可使蓝色石蕊试纸先变红后褪色 | |
| C. | 在氧化还原反应中,Cl2只能作氧化剂 | |
| D. | 若提供含0.4 mol HCl的浓盐酸,MnO2过量,则可制得标准状况下氯气2.24 L |
分析 A、实验室常用MnO2和浓盐酸共热来制取氯气;
B、氯水中含有盐酸和次氯酸分析;
C、氯气可以自身氧化还原反应;
D、随反应进行浓盐酸变化为稀盐酸不能和二氧化锰继续反应;
解答 解:A、实验室常用MnO2和浓盐酸共热来制取氯气,工业制备是电解熔融氯化钠或电解饱和食盐水,故A错误;
B、氯水中含有盐酸和次氯酸,蓝色石蕊试纸遇到氯水中的盐酸变红色,遇到次氯酸褪色,所以先变红后褪色,故B正确;
C、氯气可以自身氧化还原反应,如氯气和水反应氯气既是氧化剂也是还原剂,故C错误;
D、随反应进行浓盐酸变化为稀盐酸不能和二氧化锰继续反应,若提供含0.4 mol HCl的浓盐酸,MnO2过量,则可制得标准状况下氯气小于2.24 L,故D错误;
故选B.
点评 本题考查了氯水性质的分析判断,制备氯气的方法应用,掌握基础是关键,题目较简单.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
2.如图所示,X、Y分别是直流电源的两极,通电后后发生a极板质量增加,b极板处有无色无味气体放出.符合这一情况的是( )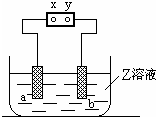

| a极板 | b极板 | X电极 | Z溶液 | |
| A | 石墨 | 石墨 | 正极 | NaOH |
| B | 铜 | 石墨 | 负极 | CuCl2 |
| C | 锌 | 石墨 | 负极 | CuSO4 |
| D | 银 | 铁 | 正极 | AgNO3 |
| A. | A | B. | B | C. | C | D. | D |
20.下列实验装置设计与对应结论正确的是( )
| 选项 | A | B | C | D |
| 装置 |  | 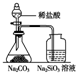 | 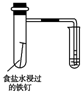 | 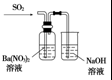 |
| 结论 | 能证明Al(OH)3不溶于氨水 | 能证明非金属性:Cl>C>Si | 验证铁发生析氢腐蚀 | 洗气瓶中产生的白色沉淀是BaSO3 |
| A. | A | B. | B | C. | C | D. | D |
17.如图为氢氧燃料电池原理示意图,下列叙述不正确的是( )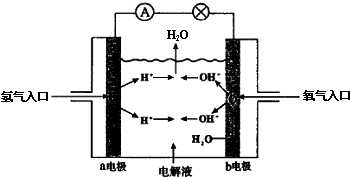

| A. | a电极是负极 | B. | b电极上发生氧化反应 | ||
| C. | 该电池工作时化学能转化为电能 | D. | 该电池的总反应为2H2+O2═2H2O |
14.下列离子方程式正确的是( )
| A. | 乙酸与碳酸钠溶液反应:2H++CO32-═CO2↑+H2O | |
| B. | 澄清石灰水中加入过量的碳酸氢钠溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O$\stackrel{△}{→}$2C6H5OH+CO32- | |
| D. | 甲醛溶液与足量的银氨溶液共热:HCHO+4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$CO32-+2NH4++4Ag↓+6NH3+2H2O |
1.新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生.下列能源不属于新能源的是( )
| A. | 氢能 | B. | 煤 | C. | 太阳能 | D. | 生物质能 |
18.下列离子方程式中正确的是( )
| A. | 少量SO2通入NaOH溶液中:OH-+SO2→HSO3- | |
| B. | H2S通入氯水中:S2-+Cl2→S↓+2Cl- | |
| C. | 二氧化氮溶于水:3NO2+H2O→2H++2NO3-+NO↑ | |
| D. | 少量NaHSO4与过量Ba(OH)2溶液反应:2H++SO42-+Ba2++2OH-→BaSO4↓+2H2O |
 .
. 乙醇(C2H5OH)是一种重要的有机物.
乙醇(C2H5OH)是一种重要的有机物.