题目内容
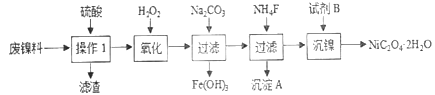
【题目】海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下图:
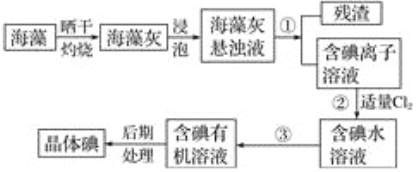
(1)实验室焙烧海带,需要下列仪器中的________(填字母)。
a.试管 b.烧杯c.坩埚 d.泥三角e.铁三脚架 f.酒精灯
(2)指出提取碘的过程中有关的实验操作名称:①________,③________。
(3)提取碘的过程中,可选择的有机试剂是________(填字母)。
A.甲苯、酒精 B.四氯化碳、苯
C.汽油、乙酸 D.汽油、甘油
(4)为使海藻灰中碘离子转化为碘的有机溶液,实验室有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器有________、________。
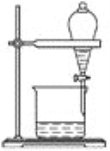
(5)小组用CCl4萃取碘水中的碘,在下图的分液漏斗中,下层液体呈________色;他们打开分液漏斗活塞,却未见液体流下,原因可能是_________________________________________。
(6)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,指出下面实验装置图中的错误之处:
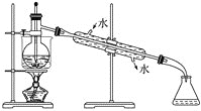
①________________________________________________________________________;
②________________________________________________________________________;
③________________________________________________________________________。
(7)进行上述蒸馏操作时,使用水浴加热的原因是________________________________________________,最后晶态碘在________里聚集。
【答案】cdef过滤萃取分液B分液漏斗普通漏斗紫红分液漏斗上口活塞小孔未与空气相通缺石棉网温度计插到了液体中冷凝管进出水的方向颠倒使蒸馏烧瓶受热均匀,控制加热温度不至过高蒸馏烧瓶
【解析】
(1)灼烧海带需要的仪器有:酒精灯、三脚架、泥三角及坩埚,故选cdef;(2)分离难溶性固体和溶液采用过滤方法,从碘水中分离出碘采用分液方法,所以①的操作名称是过滤,③的操作名称是萃取分液;(3)A.酒精和水互溶,所以不能作萃取剂,选项A错误;B.四氯化碳、苯符合萃取剂条件,所以能作萃取剂,选项B正确;C.汽油和碘反应,乙酸和水互溶,所以汽油、乙酸不能作萃取剂,选项C错误;D.汽油和碘反应、甘油和水互溶,所以汽油、甘油不能作萃取剂,选项D错误;答案选B;(4)③的操作是萃取,需要分液漏斗和普通烧杯;(5)四氯化碳的密度大于水且和水不互溶,四氯化碳能萃取碘,所以有机层在下方、水在上方,碘的四氯化碳溶液呈紫红色;如果分液漏斗上口活塞小孔未与空气相通,则液体不会流出;(6)温度计测量馏分温度,所以温度计水银球应该位于蒸馏烧瓶支管口处;冷凝管中的水遵循“下进上出”原则,否则易炸裂冷凝管;加热烧瓶需要垫石棉网,否则,烧瓶受热不均匀,故答案为:温度计水银球位置;冷凝管中水流方向;未加石棉网;(7)水浴加热时烧瓶受热均匀,且温度不至于过高而使碘转化为气态,故答案为:水浴加热时烧瓶受热均匀,且温度不至于过高,最后晶态碘在蒸馏烧瓶里聚集。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】环己酮实验室合成的反应如下:
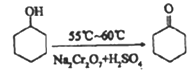
环己醇和环己酮的部分物理性质见下表:
物质 | 相对分子质量 | 沸点(℃) | 密度(g·cm-3、20℃) | 溶解性 |
环己醇 | 100 | 161.1 | 0.9624 | 能溶于水和醚 |
环己酮 | 98 | 155.6 | 0.9478 | 微溶于水,能溶于醚 |
现以20mL环己醇与足量Na2Cr2O7和硫酸的混合液充分反应,制得主要含环己酮和水的粗产品,然后进行分离提纯。其主要步骤有(未排序):
a.蒸馏、除去乙醚后,收集151℃~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.往液体中加入NaCl固体至饱和,静置,分液
d.过滤
e.加入无水MgSO4固体,除去有机物中少量水
回答下列问题:
(1)上述分提纯步骤的正确顺序是____________________。
(2)b中水层用乙醚萃取的目的是______________________。
(3)以下关于萃取分液操作的叙述中,不正确的是______________
A.水溶液中加入乙醚,转移至分液漏斗,塞上玻璃塞,如图用力振荡
B.振荡几次后需打开分液漏斗上口的玻璃塞放气
C.分液时,需先将上口玻璃塞打开或玻璃塞上的凹槽对准漏斗上的小孔,再打开旋塞待下层液体全部流尽时,再从上口倒出上层液体
D.经几次振荡并放气后,手持分漏斗静置液体分层
(4)在上述操作c中,加入NaCl固体的作用是____________________。蒸馏除乙醚的过程中采用的加热方式为_____________________。
(5)蒸馏操作时,一段时间后发现未加沸石,应采取的正确方法是______________________。
(6)利用红外光谱可以分析出环己酮的官能团为_____________________。