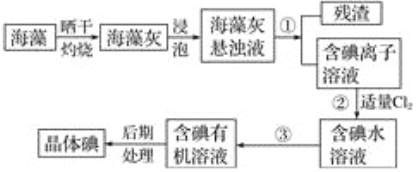
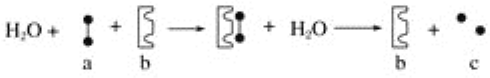题目内容
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理,对于消除环境污染有重要意义。回答下列问题:
(1)已知2NO(g)+O2(g)![]() -2NO2(g)△H的反应历程分两步:
-2NO2(g)△H的反应历程分两步:
①2NO(g)![]() N2O2(g)(快) △H1<0,v1正=k1正c2(NO),v1逆=k1逆c2(N2O2)
N2O2(g)(快) △H1<0,v1正=k1正c2(NO),v1逆=k1逆c2(N2O2)
②N2O2(g)+ O2(g) ![]() 2NO2(g)(慢) △H2<0,v2正=k2正c2(N2O2)c(O2),v2逆=k2逆c2(NO2)
2NO2(g)(慢) △H2<0,v2正=k2正c2(N2O2)c(O2),v2逆=k2逆c2(NO2)
比较反应①的活化能E1与反应②的活化能E2的大小:E1__E2(填“>”、“<”或“=”) 其判断理由是__________;2NO(g)+O2(g)![]() 2NO2(g)的平衡常数K与上述反应速率常数k1正、k1逆、k2正、k2逆的关系式为_______;已知反应速率常数k随温度升高而增大,若升高温度后k2正、k2逆分别增大a倍和b倍,则a____b(填“>”、“<”或“=”);一定条件下,2NO(g)+O2(g)
2NO2(g)的平衡常数K与上述反应速率常数k1正、k1逆、k2正、k2逆的关系式为_______;已知反应速率常数k随温度升高而增大,若升高温度后k2正、k2逆分别增大a倍和b倍,则a____b(填“>”、“<”或“=”);一定条件下,2NO(g)+O2(g) ![]() 2NO2(g)达平衡后,升高到某温度,再达平衡后v2正较原平衡减小,根据上述速率方程分析,合理的解释是_________________。
2NO2(g)达平衡后,升高到某温度,再达平衡后v2正较原平衡减小,根据上述速率方程分析,合理的解释是_________________。
(2)①以乙烯(C2H4)作为还原剂脱硝(NO),其脱硝机理如左下图所示,若反应中n(NO):n(O2) =2:1,则总反应的化学方程式为_______________;脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如右下图,为达到最佳脱硝效果,应采用的条件是________________。

②用NO可直接催化NO分解生成N2、O2,将其反应机理补充完整(Vo代表氧空穴):

2Ni2++2Vo+2NO→2Ni3++2O-+N2 2O-→+O2-+1/2O2+V。______________
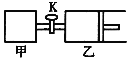
(3)电解NO可制备NH4NO3,其工作原理如右图所示,阴极的电极反应式为______________。
【答案】< 活化能越大,一般分子成为活化分子越难,反应速率越慢 k1正.k2正/(k1逆.k2逆) < 温度升高,反应①、②的平衡均逆移,由于反应①的速率大,导致c(N2O2)减小且其程度大于k2正和c(O2)增大的程度,使三者的乘积即v2正减小 6NO+3O2+2C2H4![]() 3N2+4CO2+4H2O 350℃、负载率3.0% 2Ni3+ + O2-→2Ni2+ +VO+1/2O2 NO + 6H+ +5e- = NH4+ + H2O
3N2+4CO2+4H2O 350℃、负载率3.0% 2Ni3+ + O2-→2Ni2+ +VO+1/2O2 NO + 6H+ +5e- = NH4+ + H2O
【解析】
(1)活化能越低,反应速率越快,反应达到化学平衡时,v正=v逆,由速率方程,反应速率常数k随温度升高而增大,反应②为放热反应,温度升高不利于反应正向进行,则v正<v逆,反应①为快反应,温度升高,两个反应均逆向移动,体系中c(N2O2)降低,影响v2正;(2)①由图分析,在Cu+催化作用下,C2H2作为还原剂,NO和O2转化为N2、CO2和H2O,写出反应方程式,由图象可知,需要满足脱销率尽可能大,负载率选择b,温度选择350℃;②整个反应机理过程需满足元素守恒,抓住主反应为2NO═N2+O2,其余都是中间体,整个反应过程中,各中间体需有产生、有消耗,使得三步反应机理净结果为2NO═N2+O2;(3)电解池阴极发生还原反应,NO被还原为NH4+,写出阴极的电极反应。
(1)活化能越低,反应速率越快,①为快反应,②为慢反应,则活化能大小为E1<E2,判断理由是:活化能越大,一般分子成为活化分子越难,反应速率越慢,2NO(g)+O2(g)![]() 2NO2(g) 的平衡常数K=c2(NO2)/c(O2)c2(NO),反应达到化学平衡时,v正=v逆,所以k1正c2(NO)=k1逆c2(N2O2),k2正c2(N2O2)·c(O2)=k2逆c2(NO2),则有k1正·k2正/k1逆·k2逆=
2NO2(g) 的平衡常数K=c2(NO2)/c(O2)c2(NO),反应达到化学平衡时,v正=v逆,所以k1正c2(NO)=k1逆c2(N2O2),k2正c2(N2O2)·c(O2)=k2逆c2(NO2),则有k1正·k2正/k1逆·k2逆=![]() =K,反应速率常数k随温度升高而增大,反应②为放热反应,温度升高不利于反应正向进行,则v正<v逆,所以若升高温度后k2正、k2逆分别增大a倍和b倍,则a<b,反应①为快反应,温度升高,两个反应均逆向移动,体系中c(N2O2)降低,影响v2正,导致v2正减小,可以解释为:温度升高,反应①、②的平衡均逆移,由于反应①的速率大,导致c(N2O2)减小且其程度大于k2正和c(O2)增大的程度,使三者的乘积即v2正减小;(2)①根据机理图分析,在Cu+催化作用下,C2H2作为还原剂,NO和O2转化为N2、CO2和H2O,反应中n(NO):n(O2)=2:1,所以发生反应的化学方程式为:6NO+3O2+2C2H4
=K,反应速率常数k随温度升高而增大,反应②为放热反应,温度升高不利于反应正向进行,则v正<v逆,所以若升高温度后k2正、k2逆分别增大a倍和b倍,则a<b,反应①为快反应,温度升高,两个反应均逆向移动,体系中c(N2O2)降低,影响v2正,导致v2正减小,可以解释为:温度升高,反应①、②的平衡均逆移,由于反应①的速率大,导致c(N2O2)减小且其程度大于k2正和c(O2)增大的程度,使三者的乘积即v2正减小;(2)①根据机理图分析,在Cu+催化作用下,C2H2作为还原剂,NO和O2转化为N2、CO2和H2O,反应中n(NO):n(O2)=2:1,所以发生反应的化学方程式为:6NO+3O2+2C2H4![]() 3N2+4CO2+4H2O.根据图象分析,需要满足脱销率尽可能大,负载率选择b,温度选择350℃,即温度选择350℃,负载率选择3.0%;②整个反应机理过程需满足元素守恒,消耗氧空穴,最终还需生成氧空穴,整个反应机理为:①:①2Ni2++2VO+2NO→2Ni3++2O-+N2,②2O-→O2-+1/2O2+VO,第二步机理中释放了一个O原子和一个O2-,第一步反应消耗2个氧空穴,第一步反应Ni2+转化为Ni3+,则第三步反应机理中,Ni3+需转化为Ni2+,消耗O2-,再生成一个O原子和一个氧空穴,最终还得是生成N2和O2,抓住主要反应2NO═N2+O2,其余都是中间体,各中间体需限制在三步反应机理内有产生有消耗,最终使三步反应机理净结果为2NO═N2+O2,综合考虑,则第③步反应机理应为:2Ni3++O2-→2Ni2++VO+1/2O2;(3)电解池阴极发生还原反应,NO被还原为NH4+,所以阴极的电极反应为:NO+6H++5e-=NH4++H2O。
3N2+4CO2+4H2O.根据图象分析,需要满足脱销率尽可能大,负载率选择b,温度选择350℃,即温度选择350℃,负载率选择3.0%;②整个反应机理过程需满足元素守恒,消耗氧空穴,最终还需生成氧空穴,整个反应机理为:①:①2Ni2++2VO+2NO→2Ni3++2O-+N2,②2O-→O2-+1/2O2+VO,第二步机理中释放了一个O原子和一个O2-,第一步反应消耗2个氧空穴,第一步反应Ni2+转化为Ni3+,则第三步反应机理中,Ni3+需转化为Ni2+,消耗O2-,再生成一个O原子和一个氧空穴,最终还得是生成N2和O2,抓住主要反应2NO═N2+O2,其余都是中间体,各中间体需限制在三步反应机理内有产生有消耗,最终使三步反应机理净结果为2NO═N2+O2,综合考虑,则第③步反应机理应为:2Ni3++O2-→2Ni2++VO+1/2O2;(3)电解池阴极发生还原反应,NO被还原为NH4+,所以阴极的电极反应为:NO+6H++5e-=NH4++H2O。