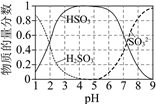题目内容
【题目】阅读下面科普信息,回答问题:
一个体重50kg的健康人含铁2 g,这2g铁在人体中以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收。
(1)在Fe+4HNO3(稀)===Fe(NO3)3+NO↑+2H2O的反应中,HNO3表现了______性,则56g Fe参加反应时,被还原的HNO3为____g。
(2)工业盐的主要成分是NaNO2,曾多次发生过因误食中毒的事件,其原因是NaNO2外观和食盐相似,又有咸味,却可以把人体内的Fe2+转化为Fe3+而失去了与O2结合的能力。(已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。)根据上述反应,可判断NaNO2具有 __________性。鉴别NaNO2和NaCl,可选用的物质有:①水 ②碘化钾淀粉试纸 ③淀粉 ④白酒 ⑤食醋,你认为必须选用的物质有______(填序号)。
(3)某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是______。
A.NaCl B.NH4Cl C.HNO3 D.浓H2SO4
(4)请配平以下化学方程式______Al+______NaNO3+______NaOH=______NaAlO2+______N2↑+______H2O;若反应过程中转移5mol电子,则生成标准状况下N2的体积为______。
【答案】酸、氧化 63 氧化 ①②⑤ B 10 6 4 10 3 2 11.2 L
【解析】
(1)由反应方程式可知硝酸中一部分生成盐,一部分价态降低生成![]() ,故硝酸表现了氧化性和酸性;
,故硝酸表现了氧化性和酸性;
(2)反应中![]() 元素的化合价降低,
元素的化合价降低,![]() 元素的化合价升高,由
元素的化合价升高,由![]() 可知,鉴别
可知,鉴别![]() 和
和![]() ,可利用碘的特 性分析;
,可利用碘的特 性分析;
(3)选择试剂时要考虑:既能使![]() 转化又无二次污染;
转化又无二次污染;
(4)![]() 元素的化合价由0升高为+3价,
元素的化合价由0升高为+3价,![]() 元素的化合价由+5价降低为0,由电子守恒及原子守恒分析;
元素的化合价由+5价降低为0,由电子守恒及原子守恒分析;
(1)由反应方程式可知硝酸中一部分生成![]() ,一部分价态降低生成
,一部分价态降低生成![]() ,故硝酸表现了氧化性和酸性;
,故硝酸表现了氧化性和酸性;
(2)反应中![]() 元素的化合价降低,
元素的化合价降低,![]() 元素的化合价升高,则还原剂为
元素的化合价升高,则还原剂为![]() ,氧化剂为
,氧化剂为![]() ,具有氧化性,由
,具有氧化性,由![]() 可知,根据题中反应,
可知,根据题中反应,![]() 在酸性溶液中,能将
在酸性溶液中,能将![]() 氧化成
氧化成 ![]() ,淀粉遇
,淀粉遇![]() 变蓝色,则选择①碘化钾淀粉试纸,⑤食醋,变蓝的为
变蓝色,则选择①碘化钾淀粉试纸,⑤食醋,变蓝的为![]() , 故答案为:①②⑤;
, 故答案为:①②⑤;
(3)![]() →
→![]() 是被还原,必须加还原剂,N元素氧化性弱于O和C元素,故只能加
是被还原,必须加还原剂,N元素氧化性弱于O和C元素,故只能加![]() 作还原剂。方程式为
作还原剂。方程式为 ![]() ,故答案为:B;
,故答案为:B;
(4)![]() 元素的化合价由0升高为+3价,
元素的化合价由0升高为+3价,![]() 元素的化合价由+5价降低为0,该反应还
元素的化合价由+5价降低为0,该反应还![]() ,过程中转移10mol
,过程中转移10mol![]() ,则转移5mol
,则转移5mol![]() 生成标准状况下
生成标准状况下![]() 的体积为 1/2×22.4L/mol=11.2L, 故答案为:10,6,4,10,3,2;11.2L。
的体积为 1/2×22.4L/mol=11.2L, 故答案为:10,6,4,10,3,2;11.2L。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案