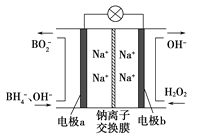
题目内容
【题目】苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等。其制备方法为:
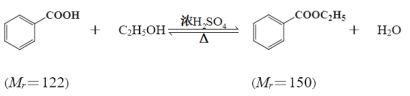
已知:
颜色、状态 | 沸点(℃) | 密度(g·cm-3) | |
苯甲酸 | 无色、片状晶体 | 249 | 1.265 9 |
苯甲酸乙酯 | 无色澄清液体 | 212.6 | 1.05 |
乙醇 | 无色澄清液体 | 78.3 | 0.789 3 |
环己烷 | 无色澄清液体 | 80.8 | 0.731 8 |
*苯甲酸在100 ℃会迅速升华。
实验步骤如下:
a.在100 mL圆底烧瓶中加入12.20 g苯甲酸、25 mL乙醇(过量)、20 mL 环己烷,以及4 mL浓硫酸,混合均匀并加入沸石,按下图所示装好仪器,控制温度在65~70 ℃加热回流2 h。反应时环己烷—乙醇—水会形成“共沸物”(沸点62.6 ℃)蒸馏出来,再利用分水器不断分离除去反应生成的水,回流环己烷和乙醇。
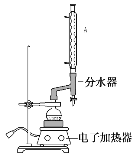
b.反应结束,打开旋塞放出分水器中液体后,关闭旋塞。继续加热,至分水器中收集到的液体不再明显增加,停止加热。
c.将烧瓶内反应液倒入盛有适量水的烧杯中,加入饱和Na2CO3溶液。
d.用分液漏斗分出有机层,水层用25 mL乙醚萃取分液,然后合并至有机层。加入氯化钙,对粗产物进行蒸馏,低温蒸出乙醚后,继续升温,接收210~213 ℃的馏分。
e.检验合格,测得产品体积为12.86 mL。
回答下列问题:
(1)反应中浓硫酸的作用是:________________。步骤a中加入沸石作用:____________。温度在65~70 ℃加热的方法是:________________。
(2)仪器A的名称是:________________。该反应类型为______________。
(3)关于步骤d中的分液操作叙述正确的是________。
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞。将分液漏斗倒转过来,用力振摇
B.振摇几次后需打开分液漏斗下口的玻璃活塞放气
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.放出液体时,需将玻璃塞上的凹槽对准漏斗口上的小孔
(4)上述实验中饱和碳酸钠溶液的作用是___________________。
(5)当达到该反应的限度,也即达到化学平衡状态。下列描述能说明该反应已达到化学平衡状态的有(填序号)_______________________。
①单位时间里,生成1mol苯甲酸乙酯,同时生成1mol水
②单位时间里,生成1mol苯甲酸乙酯,同时生成1mol乙醇
③单位时间里,消耗1mol乙醇,同时消耗1mol苯甲酸
④正反应的速率与逆反应的速率相等
⑤合物中各物质的浓度不再变化
⑥混合物中各物质的浓度相等
【答案】催化剂、吸水性 防止爆沸 水浴加热 球形冷凝管 酯化反应或取代反应, AD 吸收乙醇,中和苯甲酸,降低苯甲酸乙酯的溶解度 ②④⑤
【解析】
(1)浓硫酸作催化剂,且吸水,使反应正向移动;加入沸石防止爆沸,温度在100℃以内可以用水浴加热,受热更加均匀;
(2)有机物中,羧酸与醇类物质反应生成酯,属于酯化反应或取代反应;
(3)分流漏斗的使用方法,必须将水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞,将分液漏斗倒转过来,用力振摇,而且放出液体时,需将玻璃塞上的凹槽对准漏斗口上的小孔,只有这样液体才能顺利流下;
(4)饱和碳酸钠溶液具有吸收乙醇,中和苯甲酸,降低苯甲酸乙酯的溶解度;
(5)当正逆反应速率相等时,反应达到平衡。
(1)在酯化反应中,浓硫酸具有催化和吸水的作用,加入沸石防止爆沸,温度在65~70 ℃加热的方法是水浴加热,故答案为:催化剂、吸水性;防止爆沸;水浴加热;
(2)仪器A的名称为球形冷凝管,该反应类型为酯化反应或取代反应,故答案为:球形冷凝管;酯化反应或取代反应;
(3)A.分液漏斗的使用方法,是在水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞,将分液漏斗倒转过来,用力振摇,A正确;
B.振摇过程应该打开上口的玻璃塞放气,B错误;
C.分液漏斗要放到铁架台上静置,C错误;
D.放出液体时,需将玻璃塞上的凹槽对准漏斗口上的小孔,只有这样液体才能顺利流下,D正确;
故答案为:AD;
(4)饱和碳酸钠溶液具有吸收乙醇,中和苯甲酸,降低苯甲酸乙酯的溶解度,以便于分离的作用,故答案为:吸收乙醇,中和苯甲酸,降低苯甲酸乙酯的溶解度;
(5)①单位时间里,生成1mol苯甲酸乙酯,同时生成1mol水,都是正反应方向进行,不能说明反应达到平衡状态,①错误;
②单位时间里,生成1mol苯甲酸乙酯,同时生成1mol乙醇,说明正逆反应速率相等,能说明反应达到平衡状态,②正确;
③单位时间里,消耗1mol乙醇,同时消耗1mol苯甲酸,都是正反应方向进行,不能说明反应达到平衡状态,③错误;
④正反应的速率与逆反应的速率相等,能说明反应达到平衡状态,④正确;
⑤混合物中各物质的浓度不再变化,说明正逆反应速率相等,能说明反应达到平衡状态,⑤正确;
⑥混合物中各物质的浓度相等,不能说明反应达到平衡状态,⑥错误;故答案为:②④⑤。

 阅读快车系列答案
阅读快车系列答案【题目】一定温度下,10mL0.40molL-1H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol·L-1·min-1
B.6~10min的平均反应速率:v(H2O2)<3.3×10-2mol·L-1·min-1
C.反应至6min时,c(H2O2)=0.30mol·L-1
D.反应至6min时,H2O2分解了50%
【题目】A、B、C、D、E为原子序数依次增大的短周期主族元素,其原子半径与最外层电子数的关系如下图1。E原子最外层上的电子数是D原子最外层电子数的4倍,D离子核外电子排布与C2-相同。
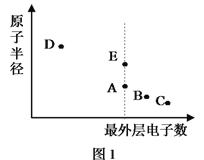
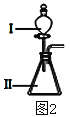
试回答:
(1)元素E在元素周期表中的位置是___________________。
(2)与元素D离子所含电子数和质子数均相同的微粒是________________。(用化学式作答,下同)
(3)B和E最高价氧化物对应的水化物,酸性较弱的_________________。若用上图2中装置验证这两种酸的酸性强弱,则在装置中加入的试剂分别为:Ⅰ___________,Ⅱ__________,观察到的实验现象是________________________。
(4)由以上五种元素组成的物质,其组成和结构信息如下表:
物质 | 组成和结构信息 |
a | 含有A、C、D的盐 |
b | C、D组成的化合物,且原子数之比为1∶1 |
c | 化学组成为AC2 |
①a含有的化学键有___________________________________;
②b与c反应的化学方程式为_________________________________。