��Ŀ����
����Ŀ��A��B��C��D��EΪԭ��������������Ķ���������Ԫ�أ���ԭ�Ӱ뾶�������������Ĺ�ϵ����ͼ1��Eԭ��������ϵĵ�������Dԭ��������������4����D���Ӻ�������Ų���C2����ͬ��

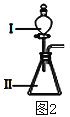
�Իش�
��1��Ԫ��E��Ԫ�����ڱ��е�λ����___________________��
��2����Ԫ��D��������������������������ͬ������________________�����û�ѧʽ������ͬ��
��3��B��E����������Ӧ��ˮ������Խ�����_________________��������ͼ2��װ����֤�������������ǿ��������װ���м�����Լ��ֱ�Ϊ����___________����__________���۲쵽��ʵ��������________________________��
��4������������Ԫ����ɵ����ʣ�����ɺͽṹ��Ϣ���±���
���� | ��ɺͽṹ��Ϣ |
a | ����A��C��D���� |
b | C��D��ɵĻ������ԭ����֮��Ϊ1��1 |
c | ��ѧ���ΪAC2 |
��a���еĻ�ѧ����___________________________________��
��b��c��Ӧ�Ļ�ѧ����ʽΪ_________________________________��
���𰸡� ��3���ڢ�A�� NH4+����H3O+�� H2SiO3��H4SiO4 HNO3 Na2SiO3 ���в�����ɫ������ ���Ӽ������ۼ� 2Na2O2+2CO2=2Na2CO3+O2
��������A��B��C��D��EΪԭ��������������Ķ���������Ԫ�أ�Eԭ��������ϵĵ�������Dԭ��������������4������D����IA�壬E���ڢ�A�壬E��A������������ͬ������ͬ���ڣ���E��ԭ�Ӱ뾶�ϴ�AΪ̼Ԫ�ء�EΪSi������������C��B��4���Ҷ���ԭ�Ӱ뾶С��̼ԭ�ӣ���B��C���ڵڶ����ڣ�C�����γ�����C2-����CΪOԪ�أ���BΪNԪ�أ�D���Ӻ�������Ų���O2-��ͬ����D����IA�壬��DΪNa��
��1��Ԫ��EΪSi����Ԫ�����ڱ��е�λ���ǣ��������ڢ�A�壻��2��Ԫ��D����ΪNa+����Na+����������������������ͬ�����ǣ�NH4+ ����H3O+������3��B��E����������Ӧ��ˮ����ֱ�ΪHNO3��H2SiO3�����Խ�����ΪH2SiO3������֤�������������ǿ��������ǿ���������ԭ��������װ���м�����Լ��ֱ�Ϊ����ΪHNO3����ΪNa2SiO3��������Ӧ��2HNO3+Na2SiO3=H2SiO3��+2NaNO3������Ϊ�����г��ְ�ɫ��״��������4������������Ԫ����ɵ���ѧ�������ʣ�a�Ǻ���C��O��Na���Σ���aΪNa2CO3��c�Ļ�ѧ���ΪAC2����cΪCO2��b��O��Na��ɵĻ������ԭ����֮��Ϊ1��1����bΪNa2O2����aΪNa2CO3���������Ӽ������ۼ�����b��c��Ӧ�Ļ�ѧ����ʽΪ��2Na2O2+2CO2=2Na2CO3+O2��

 ������״Ԫ���Ծ�ϵ�д�
������״Ԫ���Ծ�ϵ�д�����Ŀ�������ŷŵ�β��Ϊ������ȾԴ֮һ��Ŀǰ�����������»�ѧԭ�����β����2NO��2CO![]() 2CO2��N2��
2CO2��N2��
��1��д��CO2�Ľṹʽ____________��N2�ĵ���ʽ___________��
��2��һ�������£����ݻ��̶��������н���������Ӧ��COŨ����ʱ���ϵ��ͼ��ʾ��
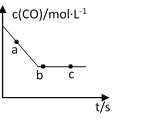
����Ӧ������(a)����(b)�� ��(c)�Ĵ�С��ϵ��______________��
�����п�˵����Ӧ����ͼ��c�����__________��
A��NO��CO��CO2��N2��ʾ�����ʱ�ֵ����2�U2�U2�U1����
B��CO��Ũ�Ȳ��ٸı�
C����Ӧ����2molNO��ͬʱ����1molN2
D�������е��������������ʵ������ֲ���
��3��Ϊ�о������߸�ת�����̷�Ӧ���ʣ�ij���������������ʵ��̽����
�����ϲ��ġ�
A����ͬ�Ĵ�����ͬһ��Ӧ�Ĵ�Ч�ʲ�ͬ��
B��ʹ�õ�������ͬ�Ĵ���ʱ�������ıȱ�����Դ�Ч����Ӱ�졣
��ʵ����ơ�������Ϊ̽��ijЩ�������������β��ת����Ӧ���ʵ�Ӱ����ɣ���������¶Ա�ʵ�顣
ʵ���� | ʵ��Ŀ�� | T/�� | NO��ʼŨ�� mol/L | CO��ʼŨ�� mol/L | ͬ�ִ����ıȱ���� m2/g | ��ƽ��ʱ���õ�ʱ��min |
�� | ����ʵ�� | 280 | 6.50��10-3 | 4.00��10-3 | 80 | t |
�� | 280 | 6.50��10-3 | 4.00��10-3 | 120 | 0.5t | |
�� | 360 | 6.50��10-3 | 4.00��10-3 | 80 | 0.2t |
�����ۡ���ʵ���Ţ��ʵ��Ŀ��Ϊ_________________________��
�ڿ�����̽���������������β��ת����Ӧ���ʵ�Ӱ�����һ������___________����____________��Ӧ���ʽ�___________�������������С��������Ӱ�족����
