题目内容
【题目】已知某种微生物燃料电池工作原理如图所示。下列有关该电池的说法中,正确的是
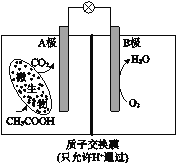
A.外电路电子从B极移向A极
B.溶液中H+由B极区移向A极区
C.电池工作一段时间后B极区溶液的pH减小
D.A极电极反应式为:CH3COOH - 8e-+2H2O=2CO2 +8H+
【答案】D
【解析】
试题分析:根据图知,A电极上C元素化合价由0价变为+4价,则A是负极、B是正极,负极反应式为CH3COOH-8e-+2H2O═2CO2↑+8H+,电解质溶液呈酸性,则正极反应式为O2+4e-+4H+=2H2O。A.通过以上分析知,A是负极、B是正极,电子从A流向B,故A错误;B.电池内电解质溶液中所含的H+由负极A移向正极B,故B错误;C.B极为正极,正极反应式为O2+4e-+4H+=2H2O,正极上消耗氢离子,所以溶液pH增大,故C错误;D.A电极上失电子发生氧化反应,则A极的电极反应为:CH3COOH-8e-+2H2O═2CO2↑+8H+,故D正确;故选D。

 名校课堂系列答案
名校课堂系列答案【题目】CO2是造成全球气候变暖的主要气体,同时也是一种来源丰富、价格低廉的碳资源。中科院福建物构所谢奎及其团队利用电能将CO2高效转化为CO,CO和H2可生产优质燃料和多种化工产品,实现碳资源的循环利用。
(1)已知反应过程中能量变化如下表和曲线图所示:
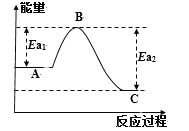
反应 | A | C | Ea1(kJ/mol) | Ea2(kJ/mol) | ΔH(kJ/mol) |
① | 2CO(g)+O2(g) | 2CO2(g) | ? | 2389 | -566 |
② | 2H2(g)+O2(g) | 2H2O(l) | 1480 | ? | -571.6 |
③ | 2CH3OH(l)+3O2(g) | 2CO2(g)+4H2O(l) | 3026 | 4478 | ΔH3 |
反应③ 的ΔH3=_________kJ/mol。
CO(g) + 2H2(g) ![]() CH3OH(l) ΔH4=_______kJ/mol;此反应中,有利于提高H2平衡转化率的条件是_______(填字母)。
CH3OH(l) ΔH4=_______kJ/mol;此反应中,有利于提高H2平衡转化率的条件是_______(填字母)。
A.高温低压 B.低温高压
C.高温高压 D.低温低压
(2)在不同的电压下,CO2、H2O混合电解转化为CO、H2的电流效率如图所示(注:电流效率![]() ×100%):
×100%):

①由图可知生成CO和H2有相互/span>_______(填“促进”、“抑制”或“无影响”)作用。
②用此法生产的CO和H2合成CH3OH,为使CO和H2利用率最高,电解时应控制电压在________ V左右(选填5、15、23、25、30)。
(3)在300℃时,将0.60molCO、1.40molH2充入4L密闭容器中,在恒温恒容下发生反应CO(g) + 2H2(g) ![]() CH3OH(g) △H<0,甲醇的物质的量浓度随时间的变化如图所示:
CH3OH(g) △H<0,甲醇的物质的量浓度随时间的变化如图所示:

①图中判断反应到达平衡状态的依据是________________。
② 5min内H2的平均反应速率v(H2) =________mol/(Lmin)。
③ 若在500℃条件下,将1.00molCO、0.50mol H2和0.50mol CH3OH充入容积为2L的密闭容器中,此时反应将_______(填字母)。
A.正反应方向反应 B.逆反应方向反应
C.达到平衡 D.无法判断










