题目内容
【题目】CO2是造成全球气候变暖的主要气体,同时也是一种来源丰富、价格低廉的碳资源。中科院福建物构所谢奎及其团队利用电能将CO2高效转化为CO,CO和H2可生产优质燃料和多种化工产品,实现碳资源的循环利用。
(1)已知反应过程中能量变化如下表和曲线图所示:
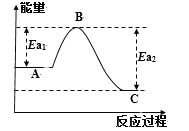
反应 | A | C | Ea1(kJ/mol) | Ea2(kJ/mol) | ΔH(kJ/mol) |
① | 2CO(g)+O2(g) | 2CO2(g) | ? | 2389 | -566 |
② | 2H2(g)+O2(g) | 2H2O(l) | 1480 | ? | -571.6 |
③ | 2CH3OH(l)+3O2(g) | 2CO2(g)+4H2O(l) | 3026 | 4478 | ΔH3 |
反应③ 的ΔH3=_________kJ/mol。
CO(g) + 2H2(g) ![]() CH3OH(l) ΔH4=_______kJ/mol;此反应中,有利于提高H2平衡转化率的条件是_______(填字母)。
CH3OH(l) ΔH4=_______kJ/mol;此反应中,有利于提高H2平衡转化率的条件是_______(填字母)。
A.高温低压 B.低温高压
C.高温高压 D.低温低压
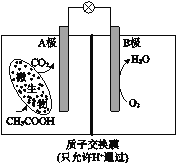
(2)在不同的电压下,CO2、H2O混合电解转化为CO、H2的电流效率如图所示(注:电流效率![]() ×100%):
×100%):

①由图可知生成CO和H2有相互/span>_______(填“促进”、“抑制”或“无影响”)作用。
②用此法生产的CO和H2合成CH3OH,为使CO和H2利用率最高,电解时应控制电压在________ V左右(选填5、15、23、25、30)。
(3)在300℃时,将0.60molCO、1.40molH2充入4L密闭容器中,在恒温恒容下发生反应CO(g) + 2H2(g) ![]() CH3OH(g) △H<0,甲醇的物质的量浓度随时间的变化如图所示:
CH3OH(g) △H<0,甲醇的物质的量浓度随时间的变化如图所示:

①图中判断反应到达平衡状态的依据是________________。
② 5min内H2的平均反应速率v(H2) =________mol/(Lmin)。
③ 若在500℃条件下,将1.00molCO、0.50mol H2和0.50mol CH3OH充入容积为2L的密闭容器中,此时反应将_______(填字母)。
A.正反应方向反应 B.逆反应方向反应
C.达到平衡 D.无法判断
【答案】-1452 -128.6 B 抑制 25 CH3OH浓度保持不变或不再随时间变化 0.02 B
【解析】
(1)根据ΔH3=反应物的活化能-生成物的活化能计算反应③的ΔH3,然后根据盖斯定律计算ΔH4;根据影响化学平衡的因素分析判断提高H2平衡转化率的方法;
(2)①由图可知,生成CO越少,生成H2越多,据此解答;
②根据方程式CO(g) + 2H2(g) ![]() CH3OH(l)分析判断使CO和H2利用率最高的电压;
CH3OH(l)分析判断使CO和H2利用率最高的电压;
(3)①根据反应到达平衡状态的特征分析解答;
② 首先计算5min内甲醇的平均反应速率,再根据化学反应速率之比=化学计量数之比计算v(H2);
③先计算300℃时的平衡常数K,该反应为放热反应,升高温度,平衡逆向移动,K减小;再计算500℃条件下,将1.00molCO、0.50mol H2和0.50mol CH3OH充入容积为2L的密闭容器中的Qc,根据Qc与K的大小,判断平衡移动的方向。
(1)反应③的ΔH3=反应物的活化能-生成物的活化能=(3026)-(4478)=-1452 kJ/mol;根据表格数据,①2CO(g)+O2(g)= 2CO2(g) ΔH1=-566 kJ/mol,②2H2(g)+O2(g)= 2H2O(l) ΔH2=-571.6 kJ/mol,③2CH3OH(l)+3O2(g)→2CO2(g)+4H2O(l) ΔH3=-1452 kJ/mol,根据盖斯定律,将(①+②×2-③)×![]() 得:CO(g) + 2H2(g)
得:CO(g) + 2H2(g) ![]() CH3OH(l) ΔH4=
CH3OH(l) ΔH4=![]() ×[(-566)+(-571.6)×2-(-1452)]kJ/mol=-128.6 kJ/mol;该反应为气体体积减小的放热反应,低温高压能够使平衡正向移动,有利于提高H2平衡转化率,故答案为:-1452; -128.6;B;
×[(-566)+(-571.6)×2-(-1452)]kJ/mol=-128.6 kJ/mol;该反应为气体体积减小的放热反应,低温高压能够使平衡正向移动,有利于提高H2平衡转化率,故答案为:-1452; -128.6;B;
(2)①由图可知,生成CO越少,生成H2越多,生成CO和H2有相互抑制的作用,故答案为:抑制;
②根据方程式CO(g) + 2H2(g) ![]() CH3OH(l)可知,为使CO和H2利用率最高,电解时应控制电压在25 V左右,故答案为:25;
CH3OH(l)可知,为使CO和H2利用率最高,电解时应控制电压在25 V左右,故答案为:25;
(3)①5min时CH3OH浓度保持不变或不再随时间变化,说明反应到达平衡状态,故答案为:CH3OH浓度保持不变或不再随时间变化;
② 5min内甲醇的平均反应速率=![]() =0.01 mol/(Lmin),则v(H2) =2v (CH3OH)= 0.02mol/(Lmin) ,故答案为:0.02;
=0.01 mol/(Lmin),则v(H2) =2v (CH3OH)= 0.02mol/(Lmin) ,故答案为:0.02;
③在300℃时,将0.60molCO、1.40molH2充入4L密闭容器中,平衡时甲醇的物质的量浓度为0.05 mol/L,物质的量为0.2mol,则反应的CO和H2分别为0.2mol、0.4mol,平衡时CO和H2物质的量浓度分别为![]() mol/L = 0.1mol/L,
mol/L = 0.1mol/L,![]() mol/L = 0.25mol/L,此时平衡常数K=
mol/L = 0.25mol/L,此时平衡常数K=![]() =8,该反应为放热反应,升高温度,平衡逆向移动,K减小;在500℃条件下,将1.00molCO、0.50mol H2和0.50mol CH3OH充入容积为2L的密闭容器中,此时CO、H2和CH3OH的浓度分别为0.5 mol/L、0.25 mol/L、0.25 mol/L,Qc=
=8,该反应为放热反应,升高温度,平衡逆向移动,K减小;在500℃条件下,将1.00molCO、0.50mol H2和0.50mol CH3OH充入容积为2L的密闭容器中,此时CO、H2和CH3OH的浓度分别为0.5 mol/L、0.25 mol/L、0.25 mol/L,Qc=![]() =8>K,平衡逆向移动,故选B
=8>K,平衡逆向移动,故选B

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+ H2O(g)![]() CO2 (g)+ H2(g)反应过程中测定的部分数据见下表(表中t2>t1):
CO2 (g)+ H2(g)反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是( )
A. 反应在t1min内的平均速率为![]()
B. 保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时n(CO2)= 0.40mol
C. 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时H2O转化率增大
D. 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应