题目内容
9.水解反应是中学化学中的一大类反应.(1)在 ①酸 ②碱 ③盐 ④不饱和烃 ⑤卤代烃 ⑥醇 ⑦醛 ⑧酯 ⑨低聚糖 ⑩蛋白质等物质中,能发生水解的物质有③⑤⑧⑨⑩(填编号).蔗糖水解的产物名称为葡萄糖、果糖.
(2)写出二甲基二氯硅烷[(CH3)2SiCl2]水解得到二甲基硅二醇的化学方程式::(CH3)2SiCl2+2H2O-→(CH3)2Si(OH)2+2HCl.
(3)溴乙烷水解实验的操作为:取一支试管,加入0.5 mL溴乙烷,再加入2 mL 5% 的NaOH溶液,充分振荡后静置,待液体分层后,用滴管小心吸取10滴上层水溶液,转入另一盛有10mL稀HNO3溶液的试管中,然后加入3滴2% 的AgNO3溶液,观察反应现象.
请根据上述操作回答以下问题:
①本实验中涉及溴乙烷的物理性质主要有难溶于水,密度比水大,稀HNO3的作用是中和过量的NaOH使溶液呈酸性.
②甲同学在盛溴乙烷和NaOH溶液的试管口塞紧带长玻璃管的单孔橡皮塞,然后水浴加热数分钟,最后液体不再分层.反应的化学方程式为CH3CH2Br+NaOH$→_{△}^{H_{2}O}$ CH3CH2OH+NaBr.
③乙同学认为:要证明上述实验中溴乙烷发生了水解反应,需要先做一个对比实验证明溴乙烷自身不能电离出溴离子,此实验操作步骤和现象是另取一支试管,加少量溴乙烷和稀硝酸,再滴加AgNO3溶液,振荡、静置,无沉淀产生.
分析 (1)能发生水解的无机物有:盐,能发生水解的有机物有:卤代烃、酯、二糖、多糖、油脂以及蛋白质等;
蔗糖水解的产物为葡萄糖和果糖;
(2)二甲基二氯硅烷[(CH3)2SiCl2]水解得到(CH3)2Si(OH)2和HCl,根据水解原理配平;
(3)①根据题意可知溴乙烷与水分层,且在水的下层;加稀HNO3酸化,以排除AgOH的影响;
②根据溴乙烷和NaOH溶液共热会发生取代反应生成乙醇和溴化钠书写方程式;
③证明溴乙烷自身不能电离出溴离子,即检验溴离子,用稀硝酸和AgNO3溶液.
解答 解:(1)能发生水解的物质有:③盐⑤卤代烃 ⑧酯 ⑨低聚糖 ⑩蛋白质;蔗糖水解得到为葡萄糖和果糖;
故答案为:③⑤⑧⑨⑩;葡萄糖、果糖;
(2)二甲基二氯硅烷[(CH3)2SiCl2]水解得到(CH3)2Si(OH)2和HCl,化学方程式为:(CH3)2SiCl2+2H2O-→(CH3)2Si(OH)2+2HCl;
故答案为:(CH3)2SiCl2+2H2O→(CH3)2Si(OH)2+2HCl;
(3)①溴乙烷与水分层,且在水的下层,则说明溴乙烷难溶于水,密度比水大;加稀HNO3中和过量的NaOH使溶液呈酸,以排除AgOH的影响;
故答案为:难溶于水,密度比水大;中和过量的NaOH使溶液呈酸性;
②溴乙烷和NaOH溶液共热反应生成乙醇和溴化钠,方程式为:CH3CH2Br+NaOH$→_{△}^{H_{2}O}$ CH3CH2OH+NaBr;
故答案为:CH3CH2Br+NaOH$→_{△}^{H_{2}O}$ CH3CH2OH+NaBr;
③检验溴离子,用稀硝酸和AgNO3溶液;具体为:另取一支试管,加少量溴乙烷和稀硝酸,再滴加AgNO3溶液,振荡、静置,无沉淀产生;
故答案为:另取一支试管,加少量溴乙烷和稀硝酸,再滴加AgNO3溶液,振荡、静置,无沉淀产生.
点评 本题考查有机物的结构与性质,把握习题中的信息及知识迁移应用为解答的关键,侧重分析与应用能力的考查,题目难度中等.

| A. | Na2CO3和Na2O2 | B. | 只有Na2CO3 | C. | Na2CO3和NaOH | D. | Na2O和NaHCO3 |
| A. | 水玻璃 | B. | 太阳能电池 | C. | 黏土 | D. | 普通水泥 |
| A. | 硅是非金属 | |
| B. | 它是非金属氧化物 | |
| C. | 二氧化硅能跟氢氧化钠反应生成盐和水 | |
| D. | 它的对应水化物是弱酸,能溶于水 |
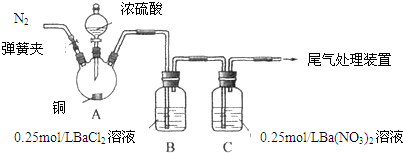
实验操作和现象:
| 操作 | 现象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上方略显浅棕色并逐渐消失 |
| 打开弹簧夹,通入N2,停止加热,一段时间后关闭 | --- |
| 从B、C中分别取少量白色沉淀,加稀盐酸 | 均未发现白色沉淀溶解 |
(2)C中白色沉淀是Ba2SO4,该沉淀的生成表明SO2具有还原性.
(3)C中液面上方生成浅棕色气体的化学方程式是2NO+O2=2NO2.
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应.
①为证实各自的观点,在原实验基础上:甲在原有操作之前增加一步操作,该操作是通N2一段时间,排除装置中的空气;乙在A、B间增加洗气瓶D,D中盛放的试剂是饱和NaHSO3溶液.
②进行实验,B中现象:甲--有大量白色沉淀;乙--有少量白色沉淀检验白色沉淀,发现均不溶于稀盐酸.结合离子方程式解释实验现象异同的原因:甲:SO42-+Ba2+→BaSO4↓,乙:2Ba2++2SO2+O2+2H2O→2BaSO4↓+4H+
白雾的量远多于装置中O2的量.
(5)合并(4)中两同学的方案进行实验.B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是SO2与可溶性钡的强酸盐不能反应生成BaSO3沉淀.
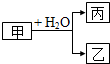 甲、乙、丙是常见的三种物质,它们之间有如图所示的转化关系.根据要求回答问题:
甲、乙、丙是常见的三种物质,它们之间有如图所示的转化关系.根据要求回答问题:Ⅰ.已知:甲是常见单质,丙为氢气.
(1)若乙为氧化物且有磁性,则乙发生铝热反应的化学方程式为8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe.
(2)若甲为碳,则产物乙、丙可合成甲醇.
①已知:CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.0kJ•mol-1
CH4(g)+H2O(g)?CH3OH(g)+H2(g)△H=+77.0kJ•mol-1
写出气体乙与气体丙反应生成CH3OH(g)的热化学方程式:CO(g)+2H2(g)=CH3OH(g)△H=-129.0kJ•mol-1.
②乙和丙合成甲醇的反应在不同温度下的化学平衡常数(K)如下表.则T1< T2(填“>”“<”、“=”).
| 温度/℃ | T1 | T2 |
| K | 2.041 | 0.012 |
Ⅱ.已知:甲是由两种短周期元素组成的化合物,丙的水溶液显碱性.
(3)若构成甲的阴、阳离子个数比为2:3,丙是气体.则构成甲的阴、阳离子半径大小关系为N3->Mg2+(用具体的微粒表示).
(4)若乙是O2,则甲的一种重要用途是供氧剂或漂白剂;产物丙与Cl2按2:1(物质的量)反应得到丁溶液,丁溶液中阴离子浓度从大到小的顺序是c(Cl-)>c(ClO-)>C(OH-).
| A. | 用剩的药品不要乱丢,要放回原试剂瓶里 | |
| B. | 给试管里的液体加热,液体的体积一般不超过试管容积的$\frac{1}{3}$ | |
| C. | 试管和烧杯都可以直接在火焰上加热 | |
| D. | 加热后的蒸发皿,要用坩埚钳夹取 |
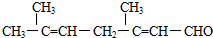 ,若要检验出其中的碳碳双键,方法是先加足量的银氨溶液使醛基氧化,然后再加入酸性的KMnO4溶液,若酸性KMnO4溶液的紫色褪去,证明有碳碳双键存在.
,若要检验出其中的碳碳双键,方法是先加足量的银氨溶液使醛基氧化,然后再加入酸性的KMnO4溶液,若酸性KMnO4溶液的紫色褪去,证明有碳碳双键存在.