题目内容
17.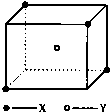 某离子晶体晶胞结构如图所示,x位于立方体的顶点,Y位于立方体中心.试分析:
某离子晶体晶胞结构如图所示,x位于立方体的顶点,Y位于立方体中心.试分析:(1)晶体中与Y最近且距离相等的X有4个,与X最近且距离相等的Y有8个该晶体的化学式为XY2.
(2)晶体中Y与其周围最近的X组成的空间构型为正四面体,距离最近的2个X与1个Y形成的夹角∠XYX的度数为109°28′.
分析 (1)立方体的8个顶点上有4个X,则每个Y连接4个X;每个X与8晶胞相连接,每个晶胞中含有一个Y离子,据此判断每个X同时吸引多少Y;根据均摊法计算晶胞中微粒数目,再写出化学式;
(2)四个X构成正四面体结构,Y位于正四面体中心,这种结构与甲烷的结构完全相同,据此判断∠XYX的度数.
解答 解:(1)由图可知,立方体的8个顶点上有4个X,Y位于晶胞内部,则与Y最近且距离相等的X有4个;每个X与8晶胞相连接,每个晶胞中含有一个Y离子,所以与X最近且距离相等的Y有8个;该晶胞中X的个数为$\frac{1}{8}$×4=$\frac{1}{2}$,Y位于晶胞内部完全属于该晶胞,则该晶胞中X与Y是个数比为1:2,则晶体的化学式为XY2,
故答案为:4;8;XY2;
(2)四个X构成正四面体结构,Y位于正四面体中心,这种结构与甲烷的结构完全相同,晶体中距离最近的2个X与1个Y形成的夹角∠XYX的度数为109°28′,
故答案为:正四面体;109°28′.
点评 本题考查了晶胞结构的分析、晶胞的计算,难度较大,会利用三线切割的方法判断配位数,会知识迁移的方法分析、解决问题.

练习册系列答案
相关题目
7.下列有机物命名正确的是( )
| A. | 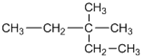 2-甲基-2-乙基甲烷 2-甲基-2-乙基甲烷 | B. | CH3C(CH3)2CH2CH3 2,2-二甲基丁烷 | ||
| C. | 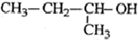 2-甲基-1-丙醇 2-甲基-1-丙醇 | D. | 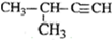 2-甲基-3-丁炔 2-甲基-3-丁炔 |
8.下列叙述正确的是( )
| A. | 苯的分子式是C6H6,不能使酸性高锰酸钾溶液褪色,属于饱和烃 | |
| B. | 从苯的凯库勒式看,分子中含有双键,所以属于烯烃 | |
| C. | 乙烯可作果实的催熟剂 | |
| D. | 充分燃烧后产生二氧化碳和水的有机物就是烃 |
5.已知氧化性:Br2>Fe3+,在FeBr2溶液中通人Cl2,则所通人Cl2与FeBr2的物质的量之比和所发生的离子方程式对应关系错误的是.( )
| 选项 | n(Cl2)/n(FeBr2) | 离子方程式 |
| A | 1:1 | 2Cl2+2Fe3++2Br-=2Fe3++Br2+4Cl- |
| B | 2:1 | 3Cl2+2Fe2++4Br-=2Fe3++2Br2+6Cl- |
| C | 1:2 | Cl2+2Br-=Br2+2Cl- |
| D | 2:3 | 4Cl2+62Fe2++2Br-=6Fe3++Br2+8Cl- |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
12.在短周期元素中,原子最外电子层只有1个或2个电子的元素是( )
| A. | 一定是金属元素 | B. | 可能是稀有气体元素 | ||
| C. | 一定不是非金属元素 | D. | 原子容易失去电子的元素 |
2.下表为元素周期表的一部分,请回答有关问题:
(1)⑤和⑧的元素符号和名称是硅 Si和氩Ar;
(2)表中最活泼的金属是Na,非金属最强的元素是F;(填写元素符号)
(3)表中能形成两性氢氧化物的元素是Al;
(4)⑨单质与水反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ⑨ | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(2)表中最活泼的金属是Na,非金属最强的元素是F;(填写元素符号)
(3)表中能形成两性氢氧化物的元素是Al;
(4)⑨单质与水反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
9.在卤代烃RCH2CH2X中化学键如图,则对该卤代烃的下列说法中正确的是( )


| A. | 不能发生水解反应和消去反应 | |
| B. | 能发生水解反应,条件是强碱的醇溶液且加热,被破坏的键是①和④ | |
| C. | 能发生消去反应,条件是强碱的水溶液且加热,被破坏的键是①和② | |
| D. | 发生水解反应时,被破坏的键是①;发生消去反应时,被破坏的键是①和③ |
 ,结构式是F-O-O-O-F.
,结构式是F-O-O-O-F.