题目内容
有一块铁的“氧化物”样品,用140mL 5.0mol·L-1 盐酸恰好将之完全溶解,所得溶液还能吸收0.025mol Cl2,恰好使其中的Fe2+全部转变为Fe3+,则该样品可能的化学式为
| A.Fe2O3 | B.Fe3O4 | C.Fe4O5 | D.Fe5O7 |
D
试题分析:0.56LCl2的物质的量为0.025mol,每摩尔Cl2可与2molFe2+反应生成2molFe3+,因为0.025mol的氯气氧化Fe2+,根据得失电子数相等有0.05molFe2+ ,5mol/L盐酸140mL即0.7molHCl,其中用于生成Fe2+得用去0.1mol ,还剩0.6mol Cl?与Fe3+形成FeCl3, 即含有0.2molFe3+,这些氧化物中含有0.2mol三价铁0.05mol二价铁,需要0.35mol氧才能电荷守恒,而铁元素共有0.25mol,氧元素共0.35mol ,最简比为5:7 ,故D项正确。

练习册系列答案
相关题目
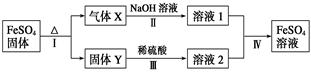
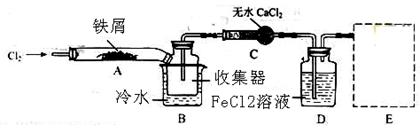
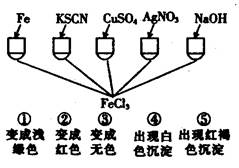
 2Fe2O3+4CO2
2Fe2O3+4CO2