题目内容
【题目】下列框图所示的物质转化关系中,甲是日常生活中常见的金属,乙、丙、丁是常见的气体单质。气体B能使湿润的红色石蕊试纸变为蓝色,丁为黄绿色气体,丙在丁中燃烧产生苍白色火焰,气体B与气体C相遇产生大量的白烟生成E,A是强碱,D是海水中浓度最高的盐(部分反应物和生成物已略去)。
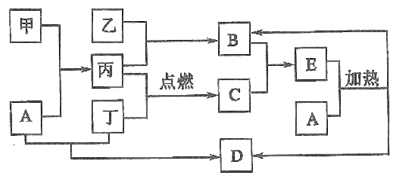
请回答下列问题:
(1)写出工业上由乙与丙生成B的化学方程式:_______________。
(2)写出甲和少量A溶液反应的离子方程式: _______________。
(3)检验E中的阳离子的方法是: _______________。
(4)B物质常见用途:_______________。(任写两条)
(5)某工厂用丁制漂白粉,写出制漂白粉的化学方程式: _______________。
【答案】 N2+ 3H2![]() 2NH3 2Al +2OH-+2H2O=2A1O2-+3H2↑ 取E溶液少量于试管中,加入NaOH浓溶液(或氢氧化钠固体]且加热,用湿润的红色石蕊试纸靠近试管口,若试纸变蓝,则E中含有NH4+ 制冷剂、制化肥、制硝酸 2Cl2+2Ca(OH)2= CaCl2 +Ca(ClO)2+2H2O
2NH3 2Al +2OH-+2H2O=2A1O2-+3H2↑ 取E溶液少量于试管中,加入NaOH浓溶液(或氢氧化钠固体]且加热,用湿润的红色石蕊试纸靠近试管口,若试纸变蓝,则E中含有NH4+ 制冷剂、制化肥、制硝酸 2Cl2+2Ca(OH)2= CaCl2 +Ca(ClO)2+2H2O
【解析】甲是日常生活中常见的金属,乙、丙、丁是常见的气体单质。气体B能使湿润的红色石蕊试纸变为蓝色,B是氨气。丁为黄绿色气体,丁是氯气。丙在丁中燃烧产生苍白色火焰,丙是氢气,乙是氮气。气体B与气体C相遇产生大量的白烟生成E,C是氯化氢,E是氯化铵。A是强碱,则甲是金属铝,D是海水中浓度最高的盐,D是氯化钠,因此A是氢氧化钠。
(1)工业上由氮气与氢气生成氨气的化学方程式为N2+3H2![]() 2NH3。(2)铝和氢氧化钠溶液反应的离子方程式为2Al+2OH-+2H2O=2A1O2-+3H2↑。(3)检验E中的铵根离子的方法是取E溶液少量于试管中,加入NaOH浓溶液(或氢氧化钠固体]且加热,用湿润的红色石蕊试纸靠近试管口,若试纸变蓝,则E中含有NH4+。(4)氨气物质常见用途为制冷剂、制化肥、制硝酸等;(5)制漂白粉的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。
2NH3。(2)铝和氢氧化钠溶液反应的离子方程式为2Al+2OH-+2H2O=2A1O2-+3H2↑。(3)检验E中的铵根离子的方法是取E溶液少量于试管中,加入NaOH浓溶液(或氢氧化钠固体]且加热,用湿润的红色石蕊试纸靠近试管口,若试纸变蓝,则E中含有NH4+。(4)氨气物质常见用途为制冷剂、制化肥、制硝酸等;(5)制漂白粉的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。



