题目内容
【题目】氮及其化合物与人类生产、生活息息相关。回答下列问题:
(1)基态氮原子中电子在2p轨道上的排布遵循的原则是______________。前4周期元素中,基态原子核外电子排布成单电子数最多的元素的价层电子排布式为____________。
(2)C、N、O三种元素第一电离能从大到小的顺序是_______________。
(3)N2F2分子中氮原子的杂化方式是____________,
1 mol N2F2含有___________molσ键。
(4)NF3的键角____________NH3的键角(填“<”“>”或“=”),原因是____________。
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。1 mol NH4BF4含有________mol配位键。
(6)安全气囊的设计原理为6NaN3+Fe2O3![]() 3Na2O+2Fe+9N2↑。
3Na2O+2Fe+9N2↑。
①等电子体的原理是原子总数相同,价电子总数相同的分子或离子具有相似的化学键特征,具有许多相近的性质。写出两种与![]() 互为等电子体的分子或离子____________;
互为等电子体的分子或离子____________;
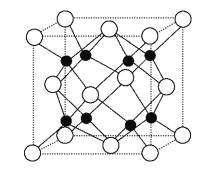
②Na2O的晶胞结构如图所示,晶胞边长为566 pm,晶胞中氧离子的配位数为____________,Na2O晶体的密度为________g·cm-3(只要求列算式,不必计算出结果)。
【答案】(1)洪特规则 3d54s1 (2)N>O>C
(3)sp2杂化 3
(4)< F电负性比H大,NF3中N周围电子密度小于NH3中N周围电子密度
(5)2
(6)①CO2、CNO- ②8 ![]()
【解析】(1)2p能级3个电子分别单独优先占据一个轨道,符合洪特规则;前4周期元素中,基态原子核外电子排布成单电子数最多,只能处于第4周期,由洪特规则特例可知价层电子排布式为3d54s1。
(2)同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素2p能级为半满稳定状态,第一电离能高于同周期相邻元素,故第一电离能:N>O>C。
(3)N2F2分子结构式为F—NN—F,分子中氮原子含有1对孤电子对,氮原子的杂化方式是sp2杂化,l mol N2F2含有3 molσ键。
(4)F电负性比H大,NF3中N周围电子密度小于NH3中N周围电子密度,成键电子对之间的排斥力较小,因而NF3的键角<NH3的键角。
(5)NH4BF4中铵根离子中含有1个配位键,硼原子与F之间形成1个配位键,l mol NH4BF4含有2 mol配位键。
(6)①与![]() 互为等电子体的分子或离子为CO2、CNO-等。
互为等电子体的分子或离子为CO2、CNO-等。
②晶胞中白色球数目为8×![]() +6×
+6×![]() =4、黑色球数目为8,钠离子与氧离子数目之比为2∶1,则白色球为氧离子、黑色球为钠离子,黑色球配位数为4,则白色球配位数为8,晶胞质量为4×
=4、黑色球数目为8,钠离子与氧离子数目之比为2∶1,则白色球为氧离子、黑色球为钠离子,黑色球配位数为4,则白色球配位数为8,晶胞质量为4×![]() g,则晶胞密度为4×
g,则晶胞密度为4×![]() g÷(566×10-10cm)3=
g÷(566×10-10cm)3=![]() g·cm-3。
g·cm-3。