题目内容
1.下列叙述正确的是( )| A. | 强电解质都是离子化合物,因此NaCl是离子化合物 | |
| B. | 醋酸溶液的导电能力可能比稀硫酸强 | |
| C. | SO3的水溶液能导电,SO3是电解质 | |
| D. | 硫磺不导电,因此硫磺是非电解质 |
分析 A.HCl为强电解质,为共价化合物;
B.导电性与离子浓度、电荷有关;
C.SO3本身不能电离;
D.硫磺为单质.
解答 解:A.HCl为强电解质,为共价化合物,则强电解质可能为离子化合物或共价化合物,故A错误;
B.导电性与离子浓度、电荷有关,浓度较大的醋酸溶液的导电能力可能比稀硫酸强,故B正确;
C.SO3本身不能电离,则为非电解质,故C错误;
D.硫磺为单质,既不是电解质,也不是非电解质,故D错误;
故选B.
点评 本题考查离子化合物及电解质等,为高频考点,把握物质的构成、电解质的判断等为解答的关键,侧重分析与应用能力的考查,注重基础知识的夯实,题目难度不大.

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案
相关题目
11.关于下列室温下的溶液的一些说法中,完全正确的是( )
①pH=4FeCl3溶液;②pH=10Na2CO3溶液;③pH=2HCl溶液;④pH=3CH3COOH溶液;⑤pH=11NaOH溶液;⑥pH=3NH4Cl溶液.
①pH=4FeCl3溶液;②pH=10Na2CO3溶液;③pH=2HCl溶液;④pH=3CH3COOH溶液;⑤pH=11NaOH溶液;⑥pH=3NH4Cl溶液.
| A. | 水的电离程度:①=②、③<④、⑤=⑥ | |
| B. | ④、⑤溶液等体积混合后所得溶液中水的电离程度大于纯水的电离程度 | |
| C. | ⑤、⑥溶液等体积混合后所得溶液中离子浓度顺序是c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| D. | ②溶液中:c(H+)+c(H2CO3)+c(HCO3-)=c(OH-) |
12.天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述错误的是( ) 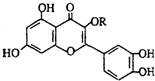

| A. | 可以和溴水反应 | |
| B. | 可用有机溶剂萃取 | |
| C. | 分子中的官能团有羟基、酯基、醚键、羰基、碳碳双键、苯环 | |
| D. | 1mol维生素P可以和4molNaOH反应 |
16.下列仪器装置的使用正确且能达到相应实验目的有 ( )
| A. |  用托盘天平快速称量一定质量的氢氧化钠固体 | |
| B. |  使用橡皮管能使漏斗中的水顺利流下 | |
| C. |  分离Cl2与KI溶液反应生成的碘 | |
| D. |  分离Cl2与KI溶液反应生成的碘 | |
| E. | 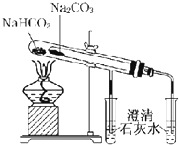 比较Na2CO3和NaHCO3的热稳定性 | |
| F. | 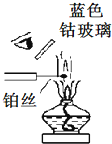 用焰色反应检验钾离子 |
6.下列说法错误的是( )
| A. | 鉴别苯与甲苯可用酸性高锰酸钾溶液 | |
| B. | 油脂和蛋白质都是能发生水解反应的高分子化合物 | |
| C. | 有机物CH3CH=CHCl存在顺反异构现象 | |
| D. | 有机物 中所有原子可能处于同一平面 中所有原子可能处于同一平面 |
10.汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3═K2O+5Na2O+16N2↑,则下列说法正确的是( )
| A. | KNO3是还原剂,其中N元素被氧化 | |
| B. | 生成物中的N2是氧化产物,K2O是还原产物 | |
| C. | 若有65 g NaN3参加反应,则被氧化N的物质的量为3.2mol | |
| D. | 每转移1 mole-,可生成标准状况下N2的体积为35.84L |
