题目内容
15.天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠有少量泄漏,可通过喷洒硫代硫酸钠溶液来处理,以减轻污染(1)氰化钠(NaCN)溶液呈碱性,其原因是CN-+H2O?HCN+OH-(用离子方程式解释).
(2)氰化钠与硫代硫酸钠的反应为:NaCN+Na2S2O3═NaSCN+Na2SO3;已知:NaSCN中S为-2价,处理掉1molNaCN,碳原子失去电子的物质的量为2mol.
分析 (1)NaCN是强碱弱酸盐,弱酸根离子水解导致溶液呈碱性;
(2)该反应中C元素化合价由+2价变为+4价,则每个C原子失去2个电子,据此计算.
解答 解:(1)NaCN是强碱弱酸盐,弱酸根离子水解生成HCN和氢氧根离子而导致溶液呈碱性,离子方程式为CN-+H2O?HCN+OH-,故答案为:CN-+H2O?HCN+OH-;
(2)该反应中C元素化合价由+2价变为+4价,则每个C原子失去2个电子,则处理掉1molNaCN,碳原子失去电子的物质的量为2mol,故答案为:2mol.
点评 本题考查盐类水解、物质的量的有关计算,为高频考点,明确盐特点及元素化合价变化是解本题关键,注意NaCN中C、N元素化合价判断,为易错点.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案
相关题目
5.下列叙述正确的是( )
①一束平行光线照射蛋白质溶液时,从侧面可看到光亮的通路
②一定温度和压强下,气体体积主要由其分子的物质的量决定
③气体摩尔体积是指单位物质的量气体所占的体积,其单位是L
④在同温同体积时,气体的物质的量越大,则压强越大
⑤用酒精萃取溴水中的溴单质的操作可选用分液漏斗,而后静置分液.
①一束平行光线照射蛋白质溶液时,从侧面可看到光亮的通路
②一定温度和压强下,气体体积主要由其分子的物质的量决定
③气体摩尔体积是指单位物质的量气体所占的体积,其单位是L
④在同温同体积时,气体的物质的量越大,则压强越大
⑤用酒精萃取溴水中的溴单质的操作可选用分液漏斗,而后静置分液.
| A. | ①②④ | B. | ①③⑤ | C. | ②③ | D. | ②④⑤ |
6.下列叙述中正确的是( )
| A. | SiO2和NO2能与强碱溶液反应,都是酸性氧化物 | |
| B. | 不锈钢材料因含有铬、镍所以抗腐蚀性好 | |
| C. | 普通玻璃、钢化玻璃、玻璃钢都属于硅酸盐产品,水玻璃可用于木材防腐 | |
| D. | MgO和A12O3熔点较高都可以做耐火材料,都能和强碱溶液反应 |
3.下列叙述中,正确的是( )
| A. | 强电解质的导电性一定比弱电解质的导电性强 | |
| B. | 溶解度小的物质的导电性一定比溶解度大的物质的导电性弱 | |
| C. | 金属元素从化合态变为游离态时,该元素一定被还原 | |
| D. | 金属阳离子得电子多时氧化性强 |
10.下列分子中的键的极性最强的是( )
| A. | H2O | B. | NH3 | C. | HF | D. | HCl |
20.下列反应的离子方程式书写正确的是( )
| A. | NaHCO3溶液中和盐酸:CO${\;}_{{3}_{\;}}$2-+2H+=H2O+CO2↑ | |
| B. | 用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O | |
| C. | 向碳酸氢铵溶液中加过量的NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 用MnS除去MnCl2溶液中的Cu2+:MnS+Cu2+=CuS+Mn2+ |
7.V L含有(NH4)2SO4和K2SO4的混合溶液,已知NH4+浓度为amol•L-1,SO42-浓度为bmol•L-1.则原混合溶液中钾离子的物质的量浓度为( )
| A. | (b-2a)bmol•L-1 | B. | $\frac{(b-2a)}{2}$bmol•L-1 | C. | (2b-a)bmol•L-1 | D. | $\frac{(2b-a)}{2}$bmol•L-1 |
4.下列有关化学用语的表示正确的是( )
| A. | 四氯化碳分子的电子式: | B. | 对硝基甲苯的结构简式: | ||
| C. | 羟基的电子式: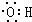 | D. | 乙醛的结构简式:CH3COH |
13.丙酮和苯酚都是重要的化工原料,工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如图:
相关化合物的物理常数
回答下列问题:
(1)反应①和②分别在装置A和C中进行(填装置符号).
(2)反应②为放热(填“放热”或“吸热”)反应.反应温度控制在50-60℃,温度过高的安全隐患是温度过高会导致爆炸.
(3)在反应器A中通入的X是氧气或空气.
(4)在分解釜C中加入的Y为少量浓硫酸,其作用是催化剂,优点是用量少,缺点是腐蚀设备.
(5)中和釜D中加入的Z最适宜的是c(填编号.已知苯酚是一种弱酸)
a.NaOH b.CaCO3 c.NaHCO3 d.CaO
(6)蒸馏塔F中的馏出物T和P分别为丙酮和苯酚,判断的依据是丙酮的沸点低于苯酚.
(7)用该方法合成苯酚和丙酮的优点是原子利用率高.

相关化合物的物理常数
| 物质 | 相对分子质量 | 密度(g/cm-3) | 沸点/℃ |
| 苯酚 | 94 | 1.0722 | 182 |
| 丙酮 | 58 | 0.7898 | 56.5 |
| 异丙苯 | 120 | 0.8640 | 153 |
(1)反应①和②分别在装置A和C中进行(填装置符号).
(2)反应②为放热(填“放热”或“吸热”)反应.反应温度控制在50-60℃,温度过高的安全隐患是温度过高会导致爆炸.
(3)在反应器A中通入的X是氧气或空气.
(4)在分解釜C中加入的Y为少量浓硫酸,其作用是催化剂,优点是用量少,缺点是腐蚀设备.
(5)中和釜D中加入的Z最适宜的是c(填编号.已知苯酚是一种弱酸)
a.NaOH b.CaCO3 c.NaHCO3 d.CaO
(6)蒸馏塔F中的馏出物T和P分别为丙酮和苯酚,判断的依据是丙酮的沸点低于苯酚.
(7)用该方法合成苯酚和丙酮的优点是原子利用率高.