ƒøƒ⁄»ð
°æƒø°øµ™ «µÿ«Ú…œ∫¨¡ø∑·∏ªµƒ“ª÷÷‘™Àÿ£¨°∞πõ™°±‘⁄π§≈©“µ…˙≤˙÷–”–◊≈÷ÿ“™◊˜”√£¨ «º∏∞ŸƒÍ¿¥ø∆—ߺ““ª÷±—–æøµƒøŒÃ‚°£œ¬±Ì¡–柡À≤ªÕ¨Œ¬∂»œ¬¥Û∆¯πõ™∫Õ𧓵πõ™µƒ≤ø∑÷K÷µ°£
∑¥”¶ | ¥Û∆¯πõ™ N2(g)+O2(g) | 𧓵πõ™ N2(g)+3H2(g) | |||
Œ¬∂»/°Ê | 27 | 2000 | 25 | 400 | 450 |
K | 3.84°¡10-31 | 0.1 | 5°¡10-8 | 2°¡104 | 7°¡103 |
£®1£©¢Ÿ∑÷Œˆ ˝æðø…÷™£∫¥Û∆¯πõ™∑¥”¶ Ù”⁄___________£®ÃÓ°∞Œ¸»»°±ªÚ°∞∑≈»»°±£©∑¥”¶°£
¢⁄‘⁄“ª∂®Œ¬∂»œ¬£¨Ω´“ª∂®◊„µƒN2∫ÕO2Õ®»ÎµΩê˝Œ™1Lµƒ√б’»ð∆˜÷–£¨µ±°∞¥Û∆¯πõ™°±∑¥”¶¥ÔµΩ∆Ω∫‚∫Û£¨∏ƒ±‰œ¬¡–Ãıº˛£¨ƒÐ π∆Ω∫‚œÚ’˝∑¥”¶∑ΩœÚ“∆∂Ø«“∆Ω∫‚≥£ ˝≤ª±‰µƒ «_______°£
a£Æ‘ˆ¥Û—π«ø b£Æ‘ˆ¥Û∑¥”¶ŒÔµƒ≈®∂» c£Æ π”√¥þªØº¡ d£Æ…˝∏þŒ¬∂»
¢€ ¥”∑÷◊”Ω·ππΩ«∂»Ω‚ Õ°∞¥Û∆¯πõ™°±∫Õ°∞𧓵πõ™°±∑¥”¶µƒªÓªØƒÐ∂º∫Ð∏þµƒ‘≠“Ú£∫________°£
£®2£©∑÷Œˆ±Ì∏Ò ˝æðø…÷™°∞¥Û∆¯πõ™°±µƒ∑¥”¶’˝œÚΩ¯––µƒ≥Ã∂»–°£¨≤ª ∫œ¥Ûπʃ£…˙≤˙£¨π ¿ΩÁ∏˜π˙æ˘≤…”√∫œ≥…∞±µƒ∑Ω∑®Ω¯––𧓵πõ™°£
¢Ÿ¥”∆Ω∫‚“∆∂ØΩ«∂»øº¬«£¨π§“µπõ™”¶∏√—°‘Ò≥£Œ¬Ãıº˛£¨µ´ µº 𧓵…˙≤˙»¥—°‘Ò500°Ê◊Û”“µƒ∏þŒ¬£¨Ω‚ Õ∆‰‘≠“Ú_______________________°£
¢⁄Ω´0.1molN2∫Õ0.1molH2Õ®»Î“ª»ðª˝ø…±‰µƒ»ð∆˜÷–Ω¯––𧓵πõ™∑¥”¶£¨‘Úœ¬ÕºÀ˘ æN2µƒ∆Ω∫‚◊™ªØ¬ ‘⁄≤ªÕ¨—π«ø(P1£¨P2)œ¬ÀÊŒ¬∂»±‰ªØµƒ«˙œþ’˝»∑µƒ «____________£®ÃÓ°∞A°± ªÚ°∞B°±)£ª±»ΩœP1°¢P2µƒ¥Û–°πÿœµ________£ª»Ù300°Ê°¢—π«øP2 ±¥ÔµΩ∆Ω∫‚£¨»ð∆˜»ðª˝«°Œ™100L£¨‘Ú¥À◊¥Ã¨œ¬∑¥”¶µƒ∆Ω∫‚≥£ ˝K=______________ (º∆À„Ω·π˚±£¡Ù2Œª”––ß ˝◊÷)°£

¢€∫œ≥…∞±∑¥”¶¥ÔµΩ∆Ω∫‚∫Û£¨t1 ±øÃ∞±∆¯≈®∂»”˚∑¢…˙ÕºC±‰ªØø…≤…»°µƒ¥Î © «____________°£

£®3£©Ω¸ƒÍΩ¸ƒÍ£¨”÷”–ø∆—ߺ“÷≥ˆ‘⁄≥£Œ¬°¢≥£—π°¢¥þªØº¡µ»Ãıº˛œ¬∫œ≥…∞±∆¯µƒ–¬Àº¬∑£¨∑¥”¶‘≠¿ÌŒ™£∫2N2(g)+6H2O(l)4NH3(g)+3O2(g)£¨‘Ú∆‰∑¥”¶»»°˜H=____________°£
£®“—÷™£∫N2(g)+3H2(g)2NH3(g) °˜H1=-92.4kJmol-1£ª2H2(g)+O2(g)2H2O(l) °˜H2=-571.6kJmol-1 £©
°æ¥∞∏°ø Œ¸»» b µ™∆¯∑÷◊”÷–N°‘Nº¸ƒÐ∫Ð¥Û£¨∂œø™N°‘N–Ë“™Œ¸ ’Ωœ∏þƒÐ¡ø ¥”∑¥”¶ÀŸ¬ Ω«∂»øº¬«£¨∏þŒ¬∏¸∫√£¨µ´¥”¥þªØº¡ªÓ–‘µ»◊€∫œ“ÚÀÿøº¬«—°‘Ò500°Ê◊Û”“∫œ A P2>P1 1.3°¡lO5 »ð∆˜»ðª˝≤ª±‰Ãıº˛œ¬“∆◊þ ¡ø∞±∆¯£¨ΩµµÕ∞±∆¯µƒ≈®∂» +1 530kJ°§mol-l
°æΩ‚Œˆ°ø(1)¢Ÿ”…±Ì∏Ò ˝æðø…÷™£¨Œ¬∂»‘Ω∏þ£¨K‘Ω¥Û£¨Àµ√˜…˝∏þŒ¬∂»£¨∆Ω∫‚’˝“∆£¨‘Ú’˝∑¥”¶∑ΩœÚŒ™Œ¸»»∑¥”¶£ª
¢⁄a£Æ∑¥”¶«∞∫Û∆¯ÃÂ◊ÐŒÔ÷ µƒ¡ø≤ª±‰£¨‘ˆ¥Û—π«ø∆Ω∫‚≤ª“∆∂Ø£¨π a≤ª’˝»∑£ªb£Æ‘ˆ¥Û∑¥”¶ŒÔµƒ≈®∂»ø…¥ŸΩ¯∆Ω∫‚’˝œÚ“∆∂Ø£¨«“≤ª”∞œÏ∆Ω∫‚≥£ ˝£¨π b’˝»∑£ªc£Æ π”√¥þªØº¡£¨∆Ω∫‚≤ª“∆∂Ø£¨π c≤ª’˝»∑£ªd£Æ∆Ω∫‚≥£ ˝÷ª ÐŒ¬∂»”∞œÏ£¨π d≤ª’˝»∑£ª¥∞∏Œ™b£ª
¢€ °∞¥Û∆¯πõ™°±∫Õ°∞𧓵πõ™°±÷–µƒ∑¥”¶ŒÔµ™∆¯µƒ∑÷◊”÷–N°‘Nº¸ƒÐ∫Ð¥Û£¨∂œø™N°‘N–Ë“™Œ¸ ’Ωœ∏þƒÐ¡ø£¨µº÷¬∑¥”¶µƒªÓªØƒÐ∂º∫Ð∏þ£ª
(2)¢Ÿ∫œ≥…∞±∑¥”¶÷–£¨∑¥”¶Œ¬∂»‘Ω∏þ£¨∑¥”¶ÀŸ¬ ‘ΩøÏ£¨µ´ «∏√∑¥”¶Œ™∑≈»»∑¥”¶£¨Œ¬∂»∏þ◊™ªØ¬ ª·ΩµµÕ£¨∂¯«“‘⁄500°Ê◊Û”“¥þªØº¡ªÓ–‘◊Ó∏þ£¨À˘“‘¥”¥þªØº¡ªÓ–‘µ»◊€∫œ“ÚÀÿøº¬«—°‘Ò500°Ê◊Û”“∫œ £ª
¢⁄∫œ≥…∞±∑¥”¶Œ™∑≈»»∑¥”¶£¨…˝∏þŒ¬∂»£¨◊™ªØ¬ ºı–°£¨À˘“‘ÕºA’˝»∑£¨B¥ÌŒÛ£ª∏√∑¥”¶’˝∑ΩœÚŒ™Ãª˝ºı–°µƒ∑ΩœÚ£¨‘ˆ¥Û—π«ø∆Ω∫‚’˝œÚ“∆∂Ø£¨◊™ªØ¬ ‘ˆ¥Û£¨ß‚2µƒ◊™ªØ¬ ¥Û£¨‘Úß‚2¥Û£ª»Ù300°Ê°¢—π«øP2 ±¥ÔµΩ∆Ω∫‚£¨N2µƒ◊™ªØ¬ Œ™10%£¨
°°°°°°°°°°°°°°°°°°°°°°N2(g)+3H2(g) ![]() 2NH3(g)
2NH3(g)
∆ ºŒÔ÷ µƒ¡ø(mol)°°0.1 0.1 0
±‰ªØŒÔ÷ µƒ¡ø(mol) 0.01 0.03 0.02
∆Ω∫‚ŒÔ÷ µƒ¡ø(mol) 0.09 0.07 0.02
∆Ω∫‚≥£ ˝K=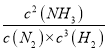 =
=![]() =1.3°¡lO5 £ª
=1.3°¡lO5 £ª
¢€”…ÕºœÒø…÷™£¨t1 ±øÃ∞±µƒ≈®∂»À≤º‰ΩµµÕ£¨∫Û∆Ω∫‚ºÃ–¯’˝œÚ“∆∂Ø£¨ø…≤…»°µƒ¥Î ©”¶ «»ð∆˜»ðª˝≤ª±‰Ãıº˛œ¬“∆◊þ ¡ø∞±∆¯£¨ΩµµÕ∞±∆¯µƒ≈®∂»£ª
(3)“—÷™£∫¢ŸN2(g)+3H2(g)![]() 2NH3(g)°˜H=-92.4kJmol-1£¨
2NH3(g)°˜H=-92.4kJmol-1£¨
¢⁄2H2(g)+O2(g)![]() 2H2O(l)°˜H=-571.6kJmol-1£¨
2H2O(l)°˜H=-571.6kJmol-1£¨
”…∏«Àπ∂®¬…£∫¢Ÿ°¡2-¢⁄°¡3µ√2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g)£¨°˜H=(-92.4kJmol-1)°¡2-(-571.6kJmol-1)°¡3=+1530 kJmol-1°£
4NH3(g)+3O2(g)£¨°˜H=(-92.4kJmol-1)°¡2-(-571.6kJmol-1)°¡3=+1530 kJmol-1°£

 ¿¯‘≈ È“µ ÓºŸœŒΩ”ƒ˛≤®≥ˆ∞Ê…Áœµ¡–¥∞∏
¿¯‘≈ È“µ ÓºŸœŒΩ”ƒ˛≤®≥ˆ∞Ê…Áœµ¡–¥∞∏°æƒø°øÕÍ≥…œ¬¡–∏˜Ã‚£Æ
(1)≥£Œ¬œ¬£¨≈®∂»æ˘Œ™ 0.1molL©Å1 µƒœ¬¡–ŒÂ÷÷ƒ∆—Œ»Ð“∫µƒ pH »Á±Ì£ª
»Ð÷ | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
…œ ˆ—Œ»Ð“∫÷–µƒ“ı¿Î◊”£¨Ω·∫œH+ƒÐ¡¶◊Ó«øµƒ « £¨∏˘æð±Ì÷– ˝æð£¨≈®∂»æ˘Œ™0.01molL©Å1 µƒœ¬¡–Àƒ÷÷À·µƒ»Ð“∫∑÷±œ° Õ 100±∂£¨pH±‰ªØ◊Ó¥Ûµƒ « (ÃÓ±ý∫≈)£Æ
A£ÆHCN B£ÆHClO C£ÆCH3COOH D£ÆH2CO3
(2)”–¢Ÿ100ml 0.1mol/L NaHCO3¢⁄100ml 0.1mol/L Na2CO3 ¡Ω÷÷»Ð“∫£∫
»Ð“∫÷–ÀƵÁ¿Î≥ˆµƒOH-∏ˆ ˝£∫¢Ÿ ¢⁄(ÃÓ°∞£æ°±°¢°∞=°±ªÚ°∞£º°±£¨œ¬Õ¨)£Æ
»Ð“∫÷–“ı¿Î◊”µƒŒÔ÷ µƒ¡ø≈®∂»÷Æ∫Õ£∫¢Ÿ ¢⁄£Æ
(3)NaCN”ˆÀÆø…≤˙…˙“◊»ºµƒHCN∆¯Ã£¨≈®∂»æ˘Œ™0.1mol£ØLµƒNaCN∫ÕHCNµƒªÏ∫œ“∫÷–µŒº”∑”Ù£¨»Ð“∫±‰∫Ï£¨‘ÚªÏ∫œ“∫÷–∏˜¿Î◊”µƒ≈®∂»¥Û–°πÿœµŒ™_______________________°£
(4)—–æø÷§ µ£¨CO2ø…‘⁄À·–‘ÀƻГ∫÷–Õ®π˝µÁΩ‚…˙≥…º◊¥º(CH3OH)£¨‘Ú…˙≥…º◊¥ºµƒ∑¥”¶∑¢…˙‘⁄ (ÃÓ“ıº´ªÚ—Ùº´)£¨∏√µÁº´∑¥”¶ Ω « °£
(5)“—÷™Ksp(CuS)£Ω1.3°¡10£≠36£¨Ksp(NiS)£Ω1.0°¡10£≠24£ª‘⁄∫¨Cu2£´£¨Ni2£´µƒ»Ð“∫÷–£¨µ±Ni2£´«°∫√ÕÍ»´≥¡µÌ[¥À ±»Ð“∫÷–c(Ni2£´)£Ω1.0°¡10£≠5 mol°§L£≠1]£¨»Ð“∫÷–Cu2£´µƒ≈®∂» «_____________mol°§L£≠1°£