题目内容
【题目】已知4g硫粉完全燃烧生成二氧化硫气体,放出37kJ热量,写出该反应的热化学方程式 .
【答案】S(s)+O2(g)═SO2(g),△H=﹣296kJ/mol
【解析】解:4g硫粉完全燃烧生成二氧化硫气体,放出37kJ的热量,所以32g硫粉完全燃烧生成二氧化硫气体,放出296kJ的热量,则热化学方程式为:S(s)+O2(g)═SO2(g),△H=﹣296kJ/mol, 所以答案是:S(s)+O2(g)═SO2(g),△H=﹣296kJ/mol.

 一线名师权威作业本系列答案
一线名师权威作业本系列答案【题目】部分弱酸的电离平衡常数如表。
弱酸 | HCOOH | H2S | H2SO3 |
电离平衡常数 (25℃) | K=1.8×10-4 | K1=9.1×10-8 K2=1.1×10-12 | K1=1.23×10-2 K2=6.6×10-8 |
(1)物质的量均为0.1mol/L的溶液①HCOONa②NaHS③Na2SO3,pH最大的是________(填编号)
(2)设计实验证明HCOOH为弱酸
(3)室温下,下列溶液中水电离出的c(H+)水由大到小的顺序为________(填编号)
①pH=12的NaOH溶液 ②NaCl溶液 ③pH=6的NH4Cl溶液 ④0.01mol/L醋酸
(4)二元酸H2A在水中存在以下电离:H2A=H++HA-,HA-![]() H++A2-,试回答下列问题:
H++A2-,试回答下列问题:
①NaHA溶液呈 (填“酸性”、“碱性”、“中性” )
②某温度下,10mL、0.1mol/LNaHA溶液中加入0.1mol/LKOH溶液VmL至中性,此时溶液中以下关系一定正确的是( )
A.溶液的pH=7 B.Kw=c2(OH-) C.V=10 D.c(K+)< c(Na+)
(5)如图横坐标为室温下溶液的pH,纵坐标为金属离子物质的量浓度的对数(当溶液中金属离子浓度≤10-5mol/L时,可认为沉淀完全)。试回答:
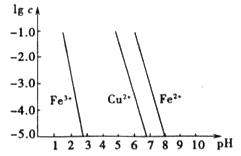
腐蚀铜板的溶液中,若Cu2+、Fe3+、Fe2+浓度均为0.1mol/L,向混合溶液中通入氨气调节溶液的pH=5.6时,溶液中存在的金属阳离子为 。
从图中的数据计算可得Fe(OH)2溶度积Ksp[Fe(OH)2]= 。
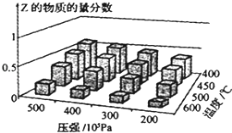
【题目】氮是地球上含量丰富的一种元素,“固氮”在工农业生产中有着重要作用,是几百年来科学家一直研究的课题。下表列举了不同温度下大气固氮和工业固氮的部分K值。
反应 | 大气固氮 N2(g)+O2(g) | 工业固氮 N2(g)+3H2(g) | |||
温度/℃ | 27 | 2000 | 25 | 400 | 450 |
K | 3.84×10-31 | 0.1 | 5×10-8 | 2×104 | 7×103 |
(1)①分析数据可知:大气固氮反应属于___________(填“吸热”或“放热”)反应。
②在一定温度下,将一定足的N2和O2通入到体积为1L的密闭容器中,当“大气固氮”反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是_______。
a.增大压强 b.增大反应物的浓度 c.使用催化剂 d.升高温度
③ 从分子结构角度解释“大气固氮”和“工业固氮”反应的活化能都很高的原因:________。
(2)分析表格数据可知“大气固氮”的反应正向进行的程度小,不适合大规模生产,故世界各国均采用合成氨的方法进行工业固氮。
①从平衡移动角度考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因_______________________。
②将0.1molN2和0.1molH2通入一容积可变的容器中进行工业固氮反应,则下图所示N2的平衡转化率在不同压强(P1,P2)下随温度变化的曲线正确的是____________(填“A” 或“B”);比较P1、P2的大小关系________;若300℃、压强P2时达到平衡,容器容积恰为100L,则此状态下反应的平衡常数K=______________ (计算结果保留2位有效数字)。

③合成氨反应达到平衡后,t1时刻氨气浓度欲发生图C变化可采取的措施是____________。

(3)近年近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(l)4NH3(g)+3O2(g),则其反应热△H=____________。
(已知:N2(g)+3H2(g)2NH3(g) △H1=-92.4kJmol-1;2H2(g)+O2(g)2H2O(l) △H2=-571.6kJmol-1 )
【题目】在一定温度下,将气体X和气体Y 各0.16 mol充入10 L 恒容密闭容器中,发生反应X(g)+ Y(g)![]() 2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表。下列说法正确的是 ( )
2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表。下列说法正确的是 ( )
t / min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A. 反应前2min的平均速率v(Z)=2.0×10-5mol/(L·min)
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大