题目内容
【题目】主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。W、X、Z最外层电子数之和为7;W、X原子序数之和是Y的一半;W与Z同族;Y的单质是我国古代四大发明之一黑火药的一种成分。下列说法错误的是( )
A.简单离子半径:![]()
B.W、X、Y三种元素电负性由强到弱的顺序为:Y>X>W
C.W与Z形成的化合物的水溶液显碱性
D.X、Z二者最高价氧化物对应水化物与Y的简单氢化物三者间两两相互反应
【答案】B
【解析】
W与Z同族,且W、X、Z最外层电子数之和为7,则三者最外层电子数可能是1,5,1、2,3,2、3,1,3;黑火药中的单质有S和C,若Y为C,则W、X的原子序数之和为3,则必有一种元素为0族元素,不符合题意“主族元素W、X、Y、Z”,所以Y为S,W、X的原子序数之和为8,再结合W、X最外层电子可能的情况可知W为H,X为N,则Z为K。
A.K+和S2-电子层数相同,但S2-核电荷数更小,半径更大,即简单离子半径:![]() ,故A正确;
,故A正确;
B.非金属性越强电负性越强,非金属性:N>S,所以电负性N>S,即X>Y,故B错误;
C.W与Z形成的化合物为KH,溶于水生成KOH,溶液显碱性,故C正确;
D.X、Z二者最高价氧化物对应的水化物为HNO3和KOH,Y的简单氢化物为H2S,硝酸和氢氧化钾可以发生中和反应,硝酸可以氧化H2S,KOH和H2S可以发生中和反应,故D正确;
故答案为B。

 中考解读考点精练系列答案
中考解读考点精练系列答案【题目】a、b、c、d、e均为周期表前四周期元素,原子序数依次增大,相关信息如下表所示。
a | 原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
b | 基态原子的p轨道电子数比s轨道电子数少1 |
c | 位于第2周期,原子核外有3对成对电子、两个未成对电子 |
d | 位于周期表中第1纵列 |
e | 基态原子M层全充满,N层只有一个电子 |
请回答:
(1)c属于_____________区的元素。
(2)b与其同周期相邻元素第一电离能由大到小的顺序为______________(用元素符号表示)。
(3)若将a元素最高价氧化物水化物对应的正盐酸根离子表示为A,则A的中心原子的轨道杂化类型为_____________,A的空间构型为____________________;
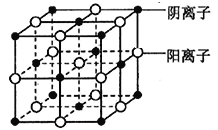
(4)d 的某氯化物晶体结构如图,每个阴离子周围等距离且最近的阴离子数为________;在e2+离子的水溶液中逐滴滴加b的氢化物水溶液至过量,可观察到的现象为_____________。